Jose Manuel Sánchez
Psicologo del Deporte y Fisioterapeuta
Profesor Master de Alto Rendimiento del F.C.Barcelona
www.recuperadoresdeportivos.es
jose@recuperadoresdeportivos.es
SUMARIO
1- Introducción
2- Lesiones musculares de causa extrínseca.Contusión Muscular
3- Lesiones musculares de causa intrínseca
4- Exploración clínica ante la lesión muscular del futbolista
5- Consecuencias de la inactividad postlesión en el músculo
6- Conclusiones
7- Bibliografía
Son muchos los futbolistas profesionales de la liga española e internacional que acuden a mi consulta ante una lesión muscular,con el objetivo de reducir el tiempo de recuperación y garantizar una buena calidad de la regeneración del tejido muscular lesionado.Actualmente estoy reduciendo a la mitad de tiempo (en comparación con la mayoria de los tratamientos convencionales) el inicio de la actividad deportiva ,tanto para las lesiones de rotura o distensión muscular de grado 1 ,como las roturas parciales de grado 2.El tratamiento acelerado propuesto por el autor a las 24 horas de la lesión muscular,permite reducir el hematoma intra o intermuscular para favorecer a través de la Microregeneración Endógena Guiada (MEG) la hiperactivación de las células satélites respecto a los fibroblastos.Al reducir el gradiente de proliferación de colágeno por parte de los fibroblastos favorecemos la neoformación de los miotubulos y la reducción del tejido cicatrizal.Las cualidades biológicas y biomecánicas son superiores a los actuales tratamientode fisioterapia revisados en la bibliografía.
Son numerosos los futbolistas profesionales que ante una rotura muscular de grado 2 (Isquiotibiales,recto femoral,gemelos...) se les mantiene entre 5 y 6 semanas de baja hasta el inicio de la actividad deportiva,me atrevería a decir que en la mayoria de los casos.En la primera semana,mi intervención es de una importancia vital para garantizar una homeostasis adecuada de la regeneración muscular.Con mi nuevo método de tratamiento estoy reduciendo el tiempo de inicio de la actividad deportiva para las roturas parciales de grado 2 a 10 días y para las de grado 1 a 4-5 días .Sin duda alguna los resultados son excelentes y ya son muchos los futbolistas profesionales de la liga nacional e internacional que se estan beneficiando de este nuevo método.Método que reduce significativamente las recaídas o recidivas,tan frecuentes en las lesiones musculares.
Las lesiones musculares,contusiones y distensiones o roturas musculares son traumatismos habituales en el futbol profesional y su incidencia supone entre el 10% y el 55% de todas las lesiones deportivas (Zarins et al,1983).Los músculos se pueden lesionar a través de un golpe directo provocando una fuerza de compresión excesiva ,es decir una contusión y si se aplica una fuerza tensora elevada ,produciendo una distensión.Desde el punto de vista etiológico las lesiones musculares las dividimos en lesiones producidas por un mecanismo extrínseco o choque directo ,donde se incluyen las contusiones musculares y las lesiones por mecanismo intrínseco secundarias a un traumatismo intramuscular,como consecuencia de movimientos balísticos y estiramientos en acción excéntrica que originan una excesiva tensión en el músculo causando su lesión.Es importante señalar los factores etiopatogénicos que favorecen la aparición de este tipo de lesiones :1) el biotipo brevilíneo o hipermusculado 2) la incidencia de lesión es mayor en los músculos biarticulares 3) el exceso o el defecto de entrenamiento,un calentamiento inadecuado y el acúmulo de fatiga y 4) condiciones ambientales como el frio y la humedad influyen notablemente en la aparición de este tipo de lesiones musculares.
Lesiones musculares de causa extrínseca.Contusión Muscular :
Se producen como consecuencia de un impacto directo sobre el músculo y éste se ve sometido a una fuerza de compresión contra el hueso subyacente ocasionando una rotura y hemorragia profunda.La lesión del tejido muscular y la hemorragia profunda se siguen de una reacción inflamatoria formándose un tejido de granulación que madurará para producir una cicatriz de tejido colágeno denso.Las contusiones musculares se localizan con mayor frecuencia en las zonas profundas del músculo,cerca del hueso (Peterson y Renström,2001) pero también pueden ser superficiales y aparecer en cualquier parte del músculo.La intensidad de estas lesiones se determina en función de la limitación de la movilidad que provocan en las articulaciones afectadas.Una contusión es leve cuando ocasiona una pérdida de menos de un tercio de la movilidad normal,mientras que las contusiones graves causan limitaciones de más de un tercio del recorrido articular normal (Peterson y Renström,2001). Para valorar el pronóstico y la velocidad de recuperación es muy útil utilizar la clasificación de Jackson y Feagin (1973) (Fig.1).
|
Intensidad
|
Sintomas
|
Amplitud de Movimiento
|
Capacidad FUncional
|
|
Leve
|
Molestias Locales
|
>90º
|
Marcha Normal |
|
Moderada
|
Masa Muscular DOlorosa.
Tumefacción |
<90º
|
Marcha antiálgica
DOlor al subir escaleras. Dolor al levantarse. |
|
Grave
|
Dolor notable.
Tumefacción elevada |
<45º
|
Cojera intensa.
(Se necesitan muletas). |
Fig. 1 : Clasificación de las contusiones del cuádriceps basada en la clasificación de Jackson y Feagin (1973).
En el momento que el músculo es sometido a un impacto brusco se producirá una hemorragia,que podrá ser intramuscular o intermuscular.En el caso de la hemorragia intramuscular ,se producirá una elevación secundaria de la presión intramuscular comprimiendo los vasos sanguíneos e impidiendo que estos sigan sangrando (Peterson y Renström,2001).Se produce una tumefacción que persiste más de 48 horas y que se acompaña de dolor y disminución de la movilidad.La sangre extravasada atrae por osmósis al líquido de los tejidos circundantes,lo que aumenta aún más el edema provocando una lesión hipóxica secundaria.Células indemnes que han escapado del daño ocasionado por el trauma o la contusión,sufrirán problemas metabólicos por falta de óxigeno a consecuencia de la menor circulación sanguínea producida por la reacción inflamatoria.En zonas donde la falta de óxigeno es importante,las células pueden morir.El hematoma aumenta de volumen a consecuencia de la acumulación de más restos tisulares producidos en la zona afectada por la lesión hipóxica secundaria.A medida que las células son destruidas por el proceso inflamatorio,liberan más proteinas libres,lo que ocasiona el edema,produciéndose la lesión secundaria adicional.El insuficiente aporte de óxigeno a las células puede provocar acidosis,el que éstas se hinchen y estallen,y finalmente que sean digeridas por las enzimas de los lisosomas destruidos.Tanto la rotura de la membrana celular como la liberación intracelular de las enzimas lisosomiales conduce a la muerte celular,y los residuos que resultan de este proceso se agregan al contenido del hematoma.De este modo la masa total de tejido dañado va aumentando.
La hemorragia intermuscular se caracteriza por la lesión de la aponeurosis que envuelve al músculo permitiendo la extravasación de la hemorragia entre los músculos.El efecto de la fuerza de la gravedad hará que el hematoma y la tumefacción aparezcan en una zona distal a la lesión al cabo de 24-48 horas.Como no se produce una elevación de la presión y el edema es transitorio,el músculo recupera rápidamente su función.Toda lesión muscular se debe de considerar potencialmente grave durante los primeros 2-3 días,siendo necesario realizar una exploración inmediata de la zona lesionada y repetirla para intentar distinguir si la hemorragia es intramuscular o intermuscular.Al cabo de 48 a 72 horas de la lesión muscular se ha de prestar atención a las siguientes cuestiones : a) ¿ha cedido la tumefacción? b) ¿se ha diseminado la hemorragia y ha provocado la aparición de hematomas a distancia de la zona lesionada? y c) ¿se ha normalizado o mejorado la capacidad contráctil del músculo?.Si la respuesta a estas tres preguntas es “no”,lo más probable es que se trate de una hemorragia intramuscular .Igualmente es importante definir la gravedad de la lesión para proporcionar al deportista el tratamiento correcto y adecuado (Peterson y Renström,2001).
La contusión muscular se manifiesta ecográficamente con la presencia de una o varias cavidades de contenido ecoico y bordes irregulares ,acompañadas de pequeñas imágenes hipoecogénicas ,que corresponden a zonas de desorganización localizada en la estructura muscular o bien a pequeños hematomas bien definidos.
El deportista que ha sufrido una contusión muscular progresa ante un programa de recuperación más rápido que el que ha sufrido una distensión o rotura parcial muscular.Ante una contusión muscular leve el tiempo de recuperación no sobrepasa los siete días,para una contusión moderada duraría aproximadamente quince días y para una contusión grave de tres a cuatro semanas.Evidentemente esta cronológia de recuperación dependerá de la extensión de la lesión, de la rapidez de la intervención por parte del recuperador deportivo y de respetar los procesos biológicos de la reparación-regeneración del tejido muscular.Ecográficamente podremos garantizar que la curación se ha completado cuando se observe un tamaño y ecogenicidad disminuida del hematoma,ecogenicidad aumentada de los márgenes del desgarro,grosor de los márgenes aumentados y retorno a la arquitectura normal del músculo.La importancia del tratamiento inmediato de las contusiones y distensiones musculares radica en que puede limitar el hematoma y por tanto favorecer el regreso al deporte en un menor plazo de tiempo.
Lesiones musculares de causa intrínseca :
Dentro de las lesiones musculares sin afectación evidente de la estructura y sin alteración ecográfica se encontraría el calambre,la contractura y el dolor muscular de origen tardío (DOMS).En este capítulo sólo describiré las lesiones estructurales del músculo por considerarlas más importantes desde la clínica deportiva y la anatomopatología, lesiones musculares en las que existe una afectación de la estructura con alteración ecográfica y se corresponderían con la elongación muscular,rotura parcial o distensión muscular y rotura total.La elongación muscular se produce como consecuencia de un estiramiento excesivo de las fibras musculares,sin provocar su rotura.El paciente se queja de dolor agudo e impotencia funcional y no existe ni hematoma ,ni equimosis ,ni tumefacción,pero a la palpación despierta dolor.
Las distensiones o roturas de fibras musculares se producen con mayor frecuencia en los músculos biarticulares (cuádriceps ,isquiotibiales,gemelos) ,como consecuencia de una descoordinación neuromuscular momentánea (Renstrom,1985).Las distensiones más frecuentes no son las roturas completas sino las roturas parciales del tejido muscular,localizándose principalmente en la unión miotendinosa (Millar,1979).
La clasificación clínica de las lesiones musculares depende de la naturaleza intramuscular o intermuscular del hematoma o de la gravedad de la lesión :
Grado I : desgarro de unas pocas fibras,aunque la aponeurosis está intacta.Si hay hematoma intramuscular,este suele tener un tamaño inferior a 1 cm .
Grado II: desgarro de un número moderado de fibras,mientras que la aponeurosis permanece intacta,aunque existe hematoma localizado.La rotura fibrilar es inferior a un tercio de la superficie muscular y el hematoma acompañante es inferior a 3cm y ocasionalmente puede haber un hematoma interfascial pequeño.
Grado III: desgarro de muchas fibras musculares con rotura parcial de la aponeurosis.La rotura de fibras afecta a más de un tercio de la superficie muscular y el hematoma es mayor de 3 cm .Siempre se acompaña de un gran hematoma interfascial.
Grado IV : corresponde a la rotura total del músculo.El músculo aparece retraido e hiperecogénico y se acompaña de un gran hematoma.En el estudio ecográfico es típica la imagen en “badajo de campana”,que traduce una solución de continuidad ,con las fibras retráctiles dentro de la cavidad hemática.
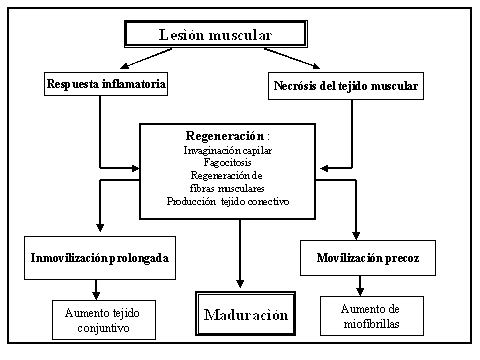
La regeneración de los elementos contráctiles comienza por la activación de las células satélites.En adultos,esta células están inactivas y se situan entre la lámina basal y el sarcolema de la fibra muscular (Mauro,1961),y se encuentra mayor cantidad de células satélites en las fibras musculares de tipo I.Cuando se rompe la lámina basal ante una lesión,es cuando se activa la capacidad mitótica de estas células.En el momento de producirse la lesión,las fibras musculares afectadas se retraen formando una brecha entre los extremos rotos, y los sarcómeros se hipertrofian para evitar el abordaje de células inflamatorias en las fibras musculares sanas (Hurme et al,1991).El traumatismo provoca la rotura de vasos sanguíneos y el hueco que queda entre las fibras musculares se rellena de sangre.En estos momentos se liberan citocinas que atraen al lugar de la lesión a los leucocitos y macrófagos (Robertson et al,1993).Durante estos primeros días los macrófagos fagocitan el tejido muscular necrosado que se halla en el espacio entre los extremos proximales y distales de las fibras musculares desgarradas. También se ha observado que los macrófagos liberan factores de crecimiento que favorecen la proliferación de las células satélites (Kuschel et al,2000).Las cantidades de leucocitos y macrófagos disminuye considerablemente entre el 5º y 7º día después de la lesión.La eliminación de estos restos celulares necrosados marca el comienzo de la regeneración,pues se activan la células satélites y se transforman en mioblastos (Carlson et al,1983).
Unos días después de la lesión, los mioblastos se fusionan entre sí para formar un miotubo,que a la vez se fusionan entre sí para formar una nueva fibra muscular (rápida o lenta) (Zhang y Dhoot,1998).Al mismo tiempo que se produce la regeneración muscular,el hematoma se ve sustituido gradualmente por los fibroblastos y los componentes de la matriz extracelular,que restauran la integridad del tejido conectivo (Jarvinen,1975). Estos dos procesos de reparación se apoyan el uno con el otro,aunque también entran en competición.Según Hurme (1991) al 7º día de la lesión los miotubos habían crecido sobre la lámina basal dañada y se observaba una lámina basal nueva.La maduración de los miotubos a miofibras aparece aproximadamente a los 14 días postlesión (Kaarianen,1998). A las pocas horas del traumatismo se detecta la presencia de fibronectina en el foco de la lesión,y esta sustancia se fija a la fibrina formando el armazón al cual se fijarán los fibroblastos.Los fibroblastos sintetizan colágeno de tipo I y tipo III,y a medida que avanza el proceso de reparación,el colágeno tipo I va adquiriendo mayor predominancia alcanzando su punto crítico máximo a las tres semanas .
Los estudios histoquímicos indican que la fusión de los miotubos requiere de un metabolismo aeróbico (Snow,1973).Por otra parte,las características mecánicas de la curación muscular guardan una estrecha relación con los cambios morfológicos ya descritos.Durante la primera semana el lugar de la lesión es el punto más débil durante los estiramientos pasivos (Jarvinen,1976).Después de la primera semana,la rotura suele producirse en la parte proximal de la lesión.Así,parece necesario procurar un período de reposo inmediatamente después de la lesión,ya que de esta manera la cantidad y densidad de tejido cicatrizal disminuye y las miofibrillas que se están regenerando pueden atravesar este tejido con mayor facilidad.
Exploración clínica ante la lesión muscular del futbolista :
La localización del dolor y el mecanismo de la lesión son los factores de mayor transcendencia en las lesiones musculares.El objetivo de la exploración clínica es poner de manifiesto la ubicación exacta del dolor y valorar la amplitud del movimiento y la fuerza muscular.Es importante realizar pruebas funcionales deportivas con el fín de evaluar al paciente desde el punto de vista físico de un deporte.El protocolo básico de exploración se basará en los siguientes elementos:
Inspección : hay que realizarla en posición de bipedestación,andando,en decúbito supino (lesiones de las regiones anteriores) y en decúbito prono (lesiones región posterior).
Palpación : del músculo afectado y regiones adyacentes que pudieran estar implicadas en la lesión.Hay que prestar atención en las posibles molestias provocadas por la tumefacción y la palpación (Brukner y Khan,2001).Cuando existe una lesión de los isquiocrurales,donde aparecen puntos de gatillo y estos pueden referir dolor,es aconsejable palpar la región glutea y la tuberosidad isquiática.
Movilidad activa : es necesario evaluar la movilidad de la articulación/es de la que el músculo lesionado forma parte.
Flexibilidad y rigidez muscular: se debe evaluar el grado de flexibilidad del músculo,así como su grado de rigidez elástica.Una disminución considerable de la flexibilidad muscular,es un indicador de la presencia de adherencias entre las fibras musculares.
Acción muscular : valorar la contracción isométrica,concéntrica y excéntrica.
Actividades de la vida diaria : verificar las limitaciones que le supone la lesión muscular comprobando la capacidad para acuclillarse sobre una pierna ,sentarse y levantarse de una silla con una pierna ,subir y bajar escaleras.Para estas acciones se necesitan tanto contracciones concéntricas como excéntricas.
Actividades deportivas : se pueden comprobar saltando,chutando y con diferentes ejercicios de carreras en los que se realicen movimientos de aceleración y desaceleración.
Consecuencias de la inactividad postlesión en el músculo :
Uno de los métodos más eficaces para la regeneración de roturas y contusiones musculares consiste en mover durante las primeras fases de curación la parte dañada,porque genera muy pocas complicaciones e incapacidades si se compara con otros tratamientos de inmovilización (Knigth,1985).Las alteraciones ultraestructurales que tienen lugar después de la inmovilización de los músculos, abarcan una necrosis segmentaria que afecta a los extremos de la fibra muscular (Baker et al,1988),siendo las fibras tipo I las que sufrirán transformaciones más intensas (Lieber et al,1988).
Un hallazgo que suele acompañar a la inmovilización es el aumento de tejido conjuntivo (endomisio,perimisio,epimisio) en relación con los tejidos contráctiles del músculo.Este tejido conjuntivo no se alinea de forma paralela a las fibras musculares,de tal manera,que este incremento de su tamaño y estructura aumentará la rigidez del músculo,disminuyendo sus propiedades de extensibilidad (Tabar et al,1972).
Las propiedades tensoras de los músculos lesionados recuperan su nivel anterior a la lesión en un tiempo corto cuando se sigue un tratamiento de movilización precoz,mientras que la inmovilización disminuye las propiedades tensoras.El entrenamiento excéntrico de baja velocidad incrementa el número de formación de sarcómeros en serie y minimiza la proliferación de colágeno.Cuando la movilización se inicia tras un breve período de inmovilización,se observa que la penetración de las fibras musculares en el tejido conjuntivo es mayor y que la orientación de las fibras musculares regeneradas está alineada con las fibras musculares intactas (Jarvinen,1975).
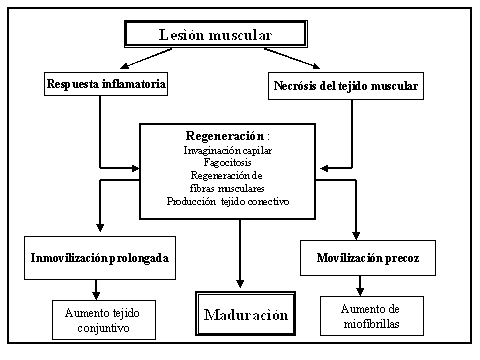
Fig 2 : Axioma del proceso de curación de una lesión muscular.Una movilización precoz del tejido lesionado estimula los receptores transmembrana del mioblasto facilitando la síntesis de proteinas necesarias para la regeneración del tejido muscular.Una inmovilización excesiva provoca un aumento del tejido conjuntivo ,creando adherencias cicatrizales alrededor de las fibras musculares.
Conocer las bases biológicas y biomecánicas del músculo nos permitirá diseñar un mejor programa de recuperación deportiva.Actualmente estoy realizando un programa de regeneración del músculo con unos resultados sorprendentes respecto a la calidad del tejido muscular ,a la reducción casi a la mitad de tiempo de inicio de la actividad deportiva,comparado con otros programas convencionales de tratamiento.Con el método de Microregeneración Endógena Guiada (MEG) consigo hiepractivar la actividad de la células satélites y por lo tanto mejorar el gradiente de neoformación de tejido muscular respecto al tejido cicatrizal.La calidad del nuevo tejido será superior al tratamiento convecional basado en los principios de terapia conservadora.Son numerosos los futbolistas profesionales que ya se están beneficiando de este nuevo método con resultados sorprendentes.
Almekinders, LC.,Temple, JD. : Etiology, diagnosis, and treatment of tendonitis: an analysis of the literature. Med Sci Sports Exerc 30, 1183,1998.
Almekinders LC., Vellema JH., Weinhold PS .: Strain patterns in the patellar tendon and the implications for patellar tendinopathy. Knee Surg Sports Traumatol Arthrosc.Jan;10(1):2-5. Epub 2001 Aug 16,2002.
Anitua E. Un nuevo enfoque en la regeneración ósea.Plasma rico en factores de crecimiento (PRGF). Puesta al día publicaciones SL;2000.
Archambault JM;Wiley JP;Bray RC. Exercice loading of tendons and the development of overuse injuries:a riew of the current literature.Sport Medicine 20(2):77-89;1995.
Aichroth PM, Patel DV, Zorrilla P. The natural history and treatment of rupture of the anterior cruciate ligament in children and adolescents. A prospective review . J Bone Joint Surg Br. 2002 Jan;84(1):38-41.
ACSM . Manual ACSM de medicina deportiva . Barcelona: Paidotribo.199
Asplin P,Ekberg E O, Thorsson O, Wilhelmsson M, Westlin N . Ultrasound examination of soft tissu injury of the lower limb in athletes . Am J Sports Med 1992;20:601-3.
Ballesteros J.M . Manual didáctico de atletismo . Madrid: Kapesluzs.199
El-Khoury GY, Brandser EA, Kathol MH, Tearse DS, Callaghan JJ . Imaging of muscle injuries . Skeletal Radiol 1996; 25:3-11.
Blazina, ME., Kerlan, RK., Jobe, FW., Carter, VS.,Carlson, JG. : Jumper's knee. Orthop Clin North Am 4, 665,1973.
Bass AL . Injuries of the leg in football . Proc R Soc Med 1967;60:527-30.
Baker,B ;et al . Review of meniscal injury and associated sport . Am J Sports Med 1985;13:1-4.
Benjamin M;Ralphs J. Functional and developmental anatomy of tendon and ligaments.In : Gordon SL;Blair SJ;Fine LJ (edi).Repetitive motions disorders of the upper extremity.American Academy of Orthopaedic Surgeons,Park Ridge,IL;1995.
Bergman AG, Fredericson M . MR imaging of stress reactions, muscle injuries, and other overuse injuries in runners . MRI Clin of North Am 1999; 7: 151-174.
Bernardino ME, Jing BS, Thomas JL, Lindell MM, Zornoza J . The extremity soft tissue lesion: a comparative study of ultrasound, computed tomography and xeroradiography . Radiology 1981;139:53:9.
Bodne D., Quinn SF., Murray WT., Bolton T, Rudd S., Lewis K., Daines P, Bishop J., Cochran C. : Magnetic resonance images of chronic patellar tendinitis . Skeletal Radiol. 17(1):24-8,1988.
Bolga, LA., Keskula, DR.: Reliability of lower extremity functional performance tests . J Orthop Sports Phys Ther 26, 138,1997.
Boni, M. y Castelli, C. Las tendinopatías por sobrecarga . Sport & Medicina.1990; 4: 3-9.
Bose, K., Kanagasuntheram, R.,Osman, MBH. : Vastus medialis oblique: an anatomical and physiologic study . Orthopedics 3, 880,1980.
Buceta, J.M. .Psicología y Lesiones deportivas: Prevención y recuperación . Madrid. 1994.
Brukner P;Khan K. Clinical Sport Medicine,2nd edn.Mc Graw-Hill,Sydney,2001.
Carr JC., Hanly S., Griffin J., Gibney R. : Sonography of the patellar tendon and adjacent structures in pediatric and adult patients. AJR Am J Roentgenol. Jun;176(6):1535-9,2001.
Clancy, WG. Leadbetter, WB., Buckwalter, JA., Gordon, SL., .: Sports-Induced Inflammation. (American Academy of Orthopaedic Surgeons, Park Ridge, IL),1990.
Clain ,MR ;et al . Overuse injuries in children and adolescents . Phys Sports Med 1989;17:111-23.
Clark M;Clerk L;Newman J et al . Interaction between metabolism and flow in tendon and muscle. Scandinavian Journal of Medicine and Science in Sport 10:338-345;2000.
Chhem RK, Kaplan PA, Dussault RG . Ultrasonography of the musculoskeletal system . Radiol Clin North Am 1994;32:275-89.
Coleman BD., Khan KM., Kiss ZS, Bartlett J., Young DA., Wark JD . : Open and arthroscopic patellar tenotomy for chronic patellar tendinopathy. A retrospective outcome study. Victorian Institute of Sport Tendon Study Group. Am J Sports Med. Mar-Apr;28(2):183-90,2000.
Coleman BD., Khan KM., Maffulli N., Cook JL., Wark JD. : Studies of surgical outcome after patellar tendinopathy: clinical significance of methodological deficiencies and guidelines for future studies. Victorian Institute of Sport Tendon Study Group. Scand J Med Sci S
Colosimo, AJ., Bassett, FH.: Jumper's knee: diagnosis and treatment .Orthop Rev 19, 139,1990.
Cook JL., Khan KM., Kiss ZS., Purdam CR., Griffiths L .: Prospective imaging study of asymptomatic patellar tendinopathy in elite junior basketball players. J Ultrasound Med.Jul;19(7):473-9,2000.
Cook, JL., Khan, KM., Harcourt, PR., Grant, M., Young, DA., Bonar, SF. : A cross sectional study of 100 athletes with jumper's knee managed conservatively and surgically .Br J Sports Med 31, 332,1997.
Cook JL., Khan KM., Harcourt PR., Kiss ZS., Fehrmann MW., Griffiths L., Wark JD . : Patellar tendon ultrasonography in asymptomatic active athletes reveals hypoechoic regions: a study of 320 tendons. Victorian Institute of Sport Tendon Study Group . Clin J Sport Med. Apr;8(2):73-7,1998.
Cook JL., Khan KM., Harcourt PR., Grant M., Young DA., Bonar SF . : A cross sectional study of 100 athletes with jumper's knee managed conservatively and surgically. The Victorian Institute of Sport Tendon Study Group. Br J Sports Med. Dec;31(4):332-6,1997.
Cook JL., Khan KM. : What is the most appropriate treatment for patellar tendinopathy? . Br J Sports Med.Oct;35(5):291-4,2001.
Cruz Feliú, J. Psicología del Deporte . Madrid, Editorial Síntesis.
Diego S ; Sagredo C . Jugar con Ventaja . Madrid, Editorial Alianza. 1997
Danova NA., Muir P .: Extracorporeal shock wave therapy for supraspinatus calcifying tendinopathy in two dogs. Vet Rec.Feb 15;152(7):208-9,2003.
DiGiovani BF;Fraga CJ;Cohen BE, et al. Associated injur ies found in chronic lateral ankle instability .Foot and Ankle International 21:809-815;2000.
Diekstall P, Rauhut F . Considerations for the indications for anterior cruciate ligament reconstruction. Results of conservative versus operative treatme nt . Unfallchirurg. 1999 Mar;102(3):173-81.
Eifert-Mangine, M., Brewster, C., Wong, M., et al . : Patellar tendinitis in the recreational athlete . Orthopedics 15, 1359,1992.
Espósito, C. y Campitelli, P . Las tendinopatías en la práctica deportiva . Sport & Medicina.1991; 8: 19-26.
Fernández A;Finlew JM. Wound healing :helping a natural process , Postgrad Med. J. 74(4),pags.311-318,1983.
Ferretti, A .: Epidemiology of jumper's knee. Sports Med 3, 289,1986.
Ferretti, A., Puddu, G., Mariani, PP.,Neri, M .: The natural history of jumper's knee: patellar or quadriceps tendonitis. Int Orth op 8, 239,1985.
Ferretti, A., Ippolito, E., Mariani, P., Puddu, G. : Jumper's knee .Am J Sports Med 11, 58,1983.
Fyfe I., Stanish WD. : The use of eccentric training and stretching in the treatment and prevention of tendon injuries. Clin Sports Med. Jul;11(3):601-24,1992.
Frank CB;Shrive NG. Ligament.In: Nigg BM;Herzog W (eds).Biomechanics of the musculo-skeletal system.jhon Wiley,Chichester,p 106-132;1994.
Fornage BD., Rifkin MD., Touche DH., Segal PM. : Sonography of the patellar tendon: preliminary observations. AJR Am J Roentgenol.Jul;143(1):179-82,1984.
Fornage BD . Muscular trauma . Clin Diagn Ultrasound 1995;30:1-10.
Fornage BD, Touche DH, Segal P, Rifkin MD . Ultrasonography in the evaluation of muscular trauma . J Ultrasound Med 1983;2:549-54.
Gavela, R . Estirar te llevará al éxito . Runner´s world, 2002; 6: 30-34.
García Soidán, J.L.y Arufe, V. Estudio de las superficies de entrenamiento de los atletas con relación a la prevención de lesiones . Efdeportes.com, 2002; 49: 1-12.
Gerster JC., Landry M, Rappoport G., Rivier G., Duvoisin B., Schnyder P . : Enthesopathy and tendinopathy in gout: computed tomographic assessment. Ann Rheum Dis.Dec;55(12):921-3,1996.
Gothelf A., Mir LM., Gehl J. : Electrochemotherapy: results of cancer treatment using enhanced delivery of bleomycin by electroporation. Cancer Treat Rev. Oct;29(5):371-87,2003.
Goldstein J, Bosco JA 3rd. The ACL-deficient knee: natural history and treatment options. Bull Hosp Jt Dis. 2001-2002;60(3-4):173-8.
Grafi-Baumann,T .La ley y la ética de las lesiones futbolísticas . Alemania, FIFA Magazine, febrero.1997
Greene BL. : Physical therapist management of fluoroquinolone-induced Achilles tendinopathy. Phys Ther. Dec;82(12):1224-31,2002.
Guillén, M . Podología deportiva en el fútbol . Madrid. Gymnos. 1999
Gutiérrez, J. Las lesiones deportivas . Madrid. Aguilar editorial. 1997
Haake M., Wirth T., Schmitt J. : Focussing of extracorporal shock wave therapy (ESWT) in the treatment of calcifying tendinitis . Joint Bone Spine. May;69 (3) : 344-5,2002.
Hayes DW J.r, Gilbertson EK., Mandracchia VJ., Dolphin TF. : Tendon pathology in the foot. The use of corticosteroid injection therapy. Clin Podiatr Med Surg.Oct;17(4):723-35,2000.
Hanten, WP., Schulthies, SS. : Exercise effect on electromyographic activity of the vastus medialis oblique and vastus lateralis muscles . Phys Ther 70, 561,1990.
Haspl M., Dubravcic-Simunjak S., Bojanic I., Pecina M. : Anterior knee pain associated with sports and work . Arh Hig Rada Toksikol. Dec;52(4):441-9,2001.
Haupt G. : Use of extracorporeal shock waves in the treatment of pseudarthrosis tendinopathy and other orthopedic diseases. Urol. Jul;158(1):4-11,1997.
Heller R., Coppola D., Pottinger C., Gilbert R., Jaroszeski MJ. : Effect of electrochemotherapy on muscle and skin. Technol Cancer Res Treat. Oct;1(5):385-92,2002.
Hess GP., Cappiello W.L, Poole RM., Hunter SC. : Prevention and treatment of overuse tendon injuries. Sports Med.Dec;8(6):371-84,1989.
Hodges, PW.,Richardson, CA. : The influence of isometric hip adduction on quadriceps femoris activity . Scand J Rehabil Med 25, 57,1993.
Horvath G. : Therapy of injuried Achilles tendon in athletes with balneotherapy in Piestany. Acta Chir Orthop Traumatol Cech. Feb;35(1):86-8,1968.
Holsbeeck van M, Introcasso J . Sonography of muscle . In: Musculoskeletal ultrasound. St. Louis: Mosby CV, 1991:48-51.
Hurme T,Kalimo H,Lehto M et al. Healing of skeleta l muscle injury :and ultastructural and inmunohistochimical study. Medicine and Science In Sport Exercise 23:801-810;1991.
Jacobson JA, Holsbeeck MT . Musculoskeletal ultrasonography. Orthop Clin North Am 1998;29:135-67.
Jackson DW, Feagin JA . Quadriceps contusion in young athletes . J Bone Joint Surg 1973;55A:95-105
Jakob RP., Segesser B. : Extension training of the quadriceps-a new concept in the therapy of tendinoses of the knee extensor apparatus (jumper's knee). Orthopade. Jun;9(3):201-6,1980.
