
Jose Manuel Sánchez
Psicologo del Deporte y Fisioterapeuta
Profesor Master de Alto Rendimiento del F.C.Barcelona
www.recuperadoresdeportivos.es
jose@recuperadoresdeportivos.es
Introducción
El dolor neuropático es secundario a una lesión más o menos extensa del sistema nervioso central o periférico y,generalmente está mediado por los receptores NMDA.El dolor neuropático (DN) se puede definir como el generado por una disfunción parcial o completa del sistema nervioso central o periférico,en donde se alteran los mecanismos de control y modulación de las vías de transmisión nociceptiva.El DN se acompaña de otros trastornos de la sensibilidad,como la táctil,donde incluso el roce puede generar un dolor intenso.
En un nervio periférico normal,las células de Schwann y el endoneuro sirven para aislar y proteger al axón (Wipple RR,1988).Tras la lesión del axón se produce una degeneración walleriana y posteriormente una regeneración del axón distal.Este proceso de reparación es adecuado cuando el endoneuro y las células de Schwann permanecen intactos.Tras una sección nerviosa (rotura del endoneuro),los axones se regeneran,pero de forma desordenada,a través de tejido circundante en un intento por alcanzar el órgano diana.En este tejido existen fibroblastos,células de Schwann,macrófagos,capilares y colágeno;es decir,es un tejido cicatrizal que,además dificulta el aporte sanguíneo al extremo axonal,colocándolo en una situación de isquemia (Barberá J et al,1993).Este crecimiento axonal desordenado y el tejido cicatrizal que lo envuelve constituye el neuroma (Bodine S et al,1994).
Para poder tratar un neuroma de origen periférico es necesario inhibir drásticamente el crecimiento axonal caótico,inhibir la descarga de impulsos en la vía nociceptiva,concretamente del nociceptor situado en la periferia y evitar la generación ectópica de impulsos,así como la transmisión efáptica de impulsos nerviosos.La Microelectrólisis Percutánea Guiada (MPG) permite bloquear y destruir estas actividades anómales,favoreciendo que la fibra nerviosa se regenere en un ambiente fisiológico,evitando de esta manera la perpetuación de estos mecanismos y,por lo tanto,los mecanismos generadores del dolor neuropático
Anatomía del nervio periférico .
El nervio periférico esta constituido por un grupo de axones ,o prolongaciones del citoplasma de la neurona que transporta y transmite los impulsos emitidos por el cuerpo celular en respuesta a los estímulos percibidos por las dendritas o por los receptores terminales.El cuerpo de las células nerviosas están situados en el asta anterior de la médula espinal cuando se trata de una célula motora y en el ganglio espinal, en la raiz dorsal de los nervios raquídeos ,cuando se trata de una célula sensitiva.
Cada fibra nerviosa contiene un axón y la vaina de tejido conectivo que la rodea,llamada,mielina.Se diferencian fibras mielínicas y amielínicas según la importancia de esta vaina constituida por las células de Schwann.Las fibras amielínicas se caracterizan por la presencia de una célula de Schwann que rodea varios axones motores.en cambio,la fibra mielínica tiene una vaina de mielina espesa, formada por enrollamiento del citoplasma de varias células de Schwann alrededor del axón (Fig1)
Fig 1 : Elementos anatómicos que componen un nervio periférico .
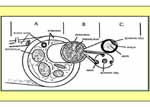
(pinchar en la imagen para ampliar)
El aporte vascular lo constituye un plexo vascular complejo, compuesto por dos sistemas arteriales uno extrínseco y otro intrínseco anastomosados entre sí. El sistema extrínseco se localiza en la superficie del nervio manteniendo una posición relativamente constante a lo largo de toda la longitud del nervio, aportando de forma mesoneural un número de arterias nutricias que varían en tamaño y número y penetran en el nervio a intervalos irregulares. Las porciones proximales a la articulación del codo de los nervios mediano y cubital presentan una vascularización predominantemente intraneural (Sunderland, 1945). Dichas ramas nutricias se ramifican repetidamente y se anastomosan con el sistema arterial intrínseco, localizado longitudinalmente en todas las láminas conectivas del nervio, creando un sistema interconectado. Los sistemas arteriales son tortuosos para permitir un desplazamiento longitudinal amplio del nervio previa constricción vascular secundaria a la tensión ejercida con los cambios posturales. Las células endoteliales de los capilares del endoneuro están interconectadas mediante uniones intercelulares, creando un sistema impermeable a una gran variedad de macromoléculas, incluyendo las proteínas. Esta barrera se ve lesionada por isquemia, traumatismo y toxinas, al igual que por histamina y serotonina procedente de los mastocitos. Los vasa vasorum están controlados por el sistema nervioso simpático.
Biomecánica del nervio periférico.
La estructura celular de los nervios periféricos le confieren unas características y propiedades electromecánicas,capacidad de plegarse y desplegarse en coordinación con el movimiento del cuerpo (Butler,2002).Las actividades electromecánicas y biomecánicas del sistema nervioso son interdependientes,y su interacción en los nervios sanos y en los lesionados recibe el nombre de neurodinámica y patodinámica (Shacklock,1995).Por otra parte,el nervio periférico tiene una gran resistencia al estiramiento y a la compresión.Variable de un nervio a otro,la resistencia a la tracción es un vector importante en los mecanismos de lesión.Para provocar una rotura del nervio ulnar,hay que ejercer una fuerza comprendida entre 9 y 26 Kg .Al romperse,el nervio se tendrá que haber alargado previamente entre un 8 y un 21% de su longitud fisiológica (Sedel,1989).Las consecuencias de los alargamientos sobre la vascularización nerviosa fueron estudiadas por Miyamoto (1986) y lo expuso de la siguiente forma: la circulación no se altera hasta un coeficiente de alargamiento del 5%,la disminución del flujo sanguíneo es reversible entre el 5 y 10%,más allá las lesiones son irreversibles.
Fisiopatologia del nervio periférico.
Las fibras nerviosas dependen para su funcionamiento normal de un suministro de sangre ininterrumpido.Un déficit sanguíneo en el nervio o una alteración de los gradientes de presión, dará lugar a la aparición de una hipóxia,edema y fibrosis.El síndrome de isquiotibiales es un ejemplo de las consecuencias que conlleva un déficit del riego sanguíneo,la rotura de fibras del tendón común de los isquiotibiales produce una colección sanguínea que se traduce en un edema extracelular,aumentando la presión exógena al nervio y reduciendo el drenaje venoso del nervio periférico.Como consecuencia del estasis venoso y la hipoxia por isquemia,se debilita la nutrición de la fibra nerviosa.La neuroisquemia cíclica sería claramente una fuente de dolor neuropático de origen periférico.Igualmente,se ha observado,en estructuras conectivas hipovasculares,como las lesiones por microtraumatismos repetitivos,que producen isquemias transitorias y por lo tanto dan lugar a una hipóxia mantenida que provoca la liberación de factor de crecimiento neural (NGF).La acción del NGF en la región isquémica estimula la proliferación de las terminaciones nerviosas libres encargadas de la información nociceptiva.Esta proliferación neurovascular de los elementos conectivos perineurales afectados por una compresión isquémica,provocan una respuesta nociceptiva de carácter ectópico,como consecuencia del déficit del riego sanguíneo y la neoformación exacerbada de terminaciones libres nociceptivas.
Desde el momento de la lesión y a partir de la instauración del edema,es probable que se produzca una proliferación fibroblástica.Si esto ocurre,el resultado será una fibrosis intraneural.Puede instaurarse un impulso anormal que genere un mecanismo de respuesta nerviosa ectópica si los componentes de las fibras nerviosas son atrapados por la alteración fibrótica del tejido conectivo.
Los signos y síntomas son más evidentes si son atrapados en la cicatriz axones inmaduros y neuromas.También se puede producir una vasoconstricción por irritación del tronco simpático,recordemos que el perineuro y el epineuro están inervados simpáticamente (Lundborg,1970).Selander et al. (1985) midieron el flujo sanguíneo en el nervio ciático de los conejos y encontraron que estimulando el tronco simpático lumbar,el flujo sanguíneo intraneural podía ser reducido hasta un 10% de los valores de control.
El sistema nervioso puede ser lesionado por una fuerza física y ambos tejidos,los conectivos y los neurales,corren un riesgo .Estudios realizados por Sunderland (1978) determinan que los tejidos conectivos del nervio periférico requieren de fuerzas grandes antes de romperse.Sin embargo,en la clínica diaria encontramos que los nervios se lesionan incluso con traumatismos menores.El epineuro no es un tejido difícil de lesionarse, y además es un tejido muy reactivo,ya que un ligero traumatismo como una compresión leve puede provocar un edema epineural (Rydevick et al,1984).Igualmente las lesiones por estiramiento afectan a una mayor masa del tejido nervioso y a unas terminales nociceptivas de los nervios nervorum,especialmente si estas terminales son atrapadas en un tejido conectivo cicatrizado.
Las alteraciones del flujo axoplasmático producidas por la lesión del nervio, se traducen como cambios tróficos en los tejidos diana (músculos,piel) y lesionan el cuerpo celular y el axón.Algunos autores, hablan de la posible relación entre epicondilitis o rotura del tendón de aquiles con una alteración del flujo axoplasmático (Butler,2002).Ambos transportes,anterógrado y retrógado,pueden ser interrumpidos por una leve compresión de 3–50mm/Hg
(Rydevick et al ,1980).Estas presiones son similares que las que produce un síndrome del tunel carpiano (Gelberman et al,1984) .En resumen, a la denervación la podemos considerar como un modelo que ilustra la relación íntima entre músculos y nervios.
Ciclo degeneración-regeneración del nervio periférico.
La lesión de un nervio periférico ,si es lo suficientemente importante,causa un daño permanente con pérdida de la sensibilidad,pérdida de la masa muscular y disminución de la fuerza muscular.En muchos casos el nervio es capaz de autoregenerarse,ya que el axón periférico puede volver a crecer bajo la influencia de un entorno favorable proporcionado por las células de Schwann.a diferencia de lo que sucede en el sistema nervioso central (SNC),donde las células gliales (astrositos y oligodendrocitos) son generalmente inhibidoras del neocrecimiento axónico,aun cuando la mayoria de las neuronas del SNC son capaces de generar nuevos axones.
Cuando un nervio periférico se lesiona ,el extremo distal del axón se va perdiendo por un proceso fisiopatológico denominado degeneración walleriana.La degeneración walleriana conlleva la eliminación y el reciclaje de los axones y de los materiales derivados de la mielina,pero deja en el lugar de la lesión las células de Schwann rodeadas por el endotubo de la lámina basal que envuelve todas las fibras nerviosas.Una vez producida la lesión se produce una infiltración de las células macrófagos que se encargarán de fagocitar el material de deshecho y además de liberar factores señales de impulso mitógeno para que las células de Schwann se multipliquen.El axón en regeneración comienza su rebrote a las pocas horas de la lesión y toma contacto con las láminas basales de las células de Schwann de un lado y con la membrana de la célula de Schwann del otro lado.Las células de Schwann producen varios factores neurotróficos,entre ellos el factor de crecimiento neural (NGF) y de esta manera,la célula de Schwann proporciona un sustrato a lo largo del cual el axón en regeneración puede crecer y,al mismo tiempo,promueve un medio humoral neurotrófico favorable.Este proceso ayuda a dirigir al axón en regeneración hacia el tejido diana siguiendo el tubo endoneural .
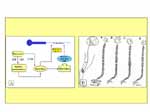
(pinchar en la imagen para ampliar)
Fig.2 : A) Esquema ilustrativo de la acción de las células inmunes en el proceso de regeneración de un nervio periférico.Los neutrófilos liberan agentes químicos que activan los nociceptores del nervio produciendo dolor.Los macrófagos liberan factores de crecimiento que actúan como impulsos mitógenos de las células de Schwann. B) Después de la sección del nervio,se produce una degeneración distal y proximal a la lesión.A través del axoplasma y células de Schwann se produce el proceso de regeneración de las terminaciones axonales.Cualquier alteración de este proceso puede dar lugar a la formación descontrolada de microneuromas terminales.
Tratamiento de neuromas yatrógenos mediante Microelectrólisis Percutánea Guiada (MPG) .
Los mecanismos generadores de dolor neuropático tras una lesión nerviosa son : a) sensibilización de los nociceptores periféricos,b) generación ectópica de impulsos nerviosos y c) transmisión efáptica de impulsos.Esta última hace referencia a la transmisión eléctrica de un potencial de acción desde una fibra nerviosa a otra (Rasminsky et al,1980).El axón generalmente conduce estímulos pero sin generar nuevos potenciales de acción.Tras una lesión del nervio periférico adquiere propiedades de marcapasos y genera potenciales ectópicos de forma espontánea.Una descarga mantenida de impulsos nociceptivos desde la periferia, provoca una sensibilización de las neuronas del asta dorsal que llevan el estímulo doloroso al cerebro (fig3).

(pinchar en la imagen para ampliar)
Fig 3) Neuroma con proliferación de las terminaciones nerviosas libres amielínicas.
Para poder tratar un neuroma de origen periférico es necesario inhibir drásticamente el crecimiento axonal caótico,inhibir la descarga de impulsos en la vía nociceptiva,ya sea de un nociceptor en la periferia y evitar la generación ectópica de impulsos,así como la transmisión efáptica de impulsos nerviosos.La MPG permite bloquear y destruir estas actividades anómales,favoreciendo que la fibra nerviosa se regenere en un ambiente fisiológico,evitando de esta manera la perpetuación de estos mecanismos y,por lo tanto,los mecanismos generadores del dolor neuropático.
La técnica de MPG la estoy aplicando desde el año 2000 en patologías crónicas de tejido blando (tendinopatìas, neuromas, fibrosis musculares y síndromes compartimentales) siendo los resultados realmente sorprendentes por su rápido mecanismo de acción sobre el tejido afectado.En oncología se practica una técnica parecida (electroquimioterapia) con ciertas modificaciones de los parámetros, para favorecer la penetración de las drogas citotóxicas dentro de las células cancerosas (Okino, M. 1987) .
Durante mucho tiempo se ha sabido que la aplicación de corriente galvánica en una solución de agua salada,produce una reacción química.La corriente eléctrica hace que la sal (NaCl) y el agua (H2O) se descompongan en sus elementos químicos constitutivos,los cuales se reagrupan entre ellos para formar sustancias completamente nuevas.A este proceso se le llama electrólisis.Las nuevas sustancias que se forman son el hidróxido de sodio (NaOH) ,gas hidrógeno (H2) y el gas cloro (Cl2).Los gases en nuestro caso son de poca importancia,pero el hidróxido de sodio o la "lejía orgánica",por ser altamente caustica,es un instrumento efectivo de destrucción cuando se realiza en la región del tejido neural alterado. La MPG es básicamente un proceso químico en el que no existe ni "cocción" ni "electrocución" del tejido.Cuando introducimos una aguja en la región del neuroma que vamos a tratar y se aplica corriente eléctrica,las sales del tejido intersticial combinadas con la humedad de la propia sustancia fundamental se convierte en "lejía orgánica" y es esta lejía la que provocará una destrucción del tejido y la respuesta inflamatoria necesaria para su reparación .
Toda materia viva está formada por unidades de construcción diminutas llamadas moléculas, que a su vez están formadas por átomos.En el agua,cada molécula está compuesta por dos átomos de hidrógeno y uno de oxígeno (H2O).Bajo la influencia de la MPG,estos átomos se dividen (se ionizan) en un ión de hidróxilo (OH) y un ión de hidrógeno (H).Los iones son inestables y como consecuencia tienden a recombinarse con otros iones.Al mismo tiempo que las moléculas de agua se descomponen, también lo hacen las moléculas de sal.Una molécula de sal (NaCl) se compone de un átomo de sodio (Na) y de un átomo de cloro (Cl) y durante la MPG simplemente se descomponen en un ión de sodio y un ión de cloruro (Sánchez JM,2003).
Todos los iones producidos durante la MPG tienden a reagruparse rápidamente.Observamos que los iones de cloruro se acoplan en pares estables (Cl2) para formar moléculas de gas de cloro.Análogamente los iones de hidrógeno se emparejan para formar gas hidrógeno (H2).Pero lo más importante,es que cada ión de sodio (Na) tiende a combinarse con un ión de hidróxilo (OH) para formar hidróxido de sodio (NaOH).Esta será nuestra herramienta terapeútica la "lejía orgánica" para el tratamiento de los neuromas (fig.4).
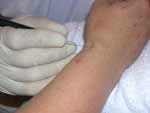
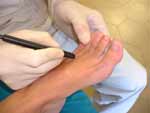
(pinchar en la imagen para ampliar)
Fig 4. A ) Tratamiento mediante MPG e un neuroma de la rama superficial del nervio radiall. B) Tratamiento por microelectrólisis percutánea guiada de un neuroma de Morton (Sánchez JM,2004) .
La MPG provoca una reacción química en el foco del neuroma o microneuromas dando lugar a un proceso de destrucción del tejido neural y fibrótico. Igualmente el contacto directo de las aguja con el tejido afectado proporciona la licuefacción de la sustancia mixoide y la rotura de enlaces de proteinas libres permitiendo su deambulación para ser reabsorvidos por lo neocapilares. Respecto a la hiperinervación perivascular en los nervios periféricos de características amielínicas ,el efecto polaridad del cátodo provocará una ionocinesia de los neurotransmisores excitatorios liberados por las células en su proceso de destrucción.La ionocinesia favorece la liberación de la despolarización prolongada del nervio sin perjudicar su umbral de reposo y la destrucción de los botones presinápticos producidos por la hiperinervación.El efecto biológico producido por la MPG es básicamente destruir los nódulos fibróticos característicos de los neuromas de origen periférico. (Sánchez JM,2003).La dosis de la EPI viene determinada por el tiempo de aplicación y la intensidad, y en cualquier caso,la intensidad prevalecerá sobre el tiempo para asegurar mayor efecto caústico.En el momento de la destrucción del nódulo fibrótico ,se produce una respuesta inflamatoria que dará lugar a una neoangiogénesis de los capilares adyacentes e intactos, que irán invadiendo la región de la lesión .Los mediadores químicos liberados por las células lesionadas (histamina,bradicina) juegan un papel primordial para indicar la formación del entramado capilar en el locus de lesión.Los neutrófilos tienen una vida corta y serán los primeros en llegar al lugar de la lesión yatrogénica , fagocitando los productos de desecho causados por la destrucción electroquímica. Este proceso de migración y fagocitosis se efectúa a las pocas horas de producir el trauma y la migración de las células fagocitarias están facilitadas por la liberación de sustancias químicas quimiotáxicas en el lugar del daño,de tal manera que actúan como informadores de localización de la lesión y lugar donde se necesita la neovascularización para favorecer el aporte de nutrientes y oxigeno.Uno o dos días más tarde,hacen apto de presencia los macrófagos, colaborando a garantizar la continuidad del proceso de fagocitosis . La aplicación de la MPG tendrá unos efectos directos inmediatos sobre el tejido dependiendo del electrodo activo . Al utilizar como electrodo activo el cátodo,dará lugar a una irritación y destrucción del neuroma,asociado a licuefacción de la sustancia mixoide .En el tratamiento de neuromas con la técnica de MPG, es importante determinar los portales de entrada para evitar cualquier efecto yatrágeno como sería la lesión de nervios o vasos adyacentes (fig.4).
Después de cada sesión donde aplicamos la MPG ,es fundamental educar al paciente a mantenerse en el sector de carga de homeostasis o límite de funcionalidad,para no irritar la región afectada. Una vez introducimos la aguja en el portal elegido y determinamos la angulación idónea ,verificamos la destrucción del nódulo del neuroma cuando la aguja no encuentre resistencia elástica en el tejido cauterizado (Sánchez JM,2003).La vasodilatación provocada por la aguja catódica, favorece la diapédesis y por lo tanto la migración de los neutrófilos a la región microtraumatizada.En el tejido en contacto con la aguja, se produce un efecto liófilo pasando el material de la sustancia mixoide de su estado gel, a un estado sol mucho más fluidíco, para permitir la recaptación de los catabolitos ,además de facilitar la normalización del ph del entorno y la PO2.Debido al gradiente de intensidad, se produce una contrairritación en las terminaciones nociceptivas, asociado a una destrucción de los terminales sinápticos,normalizando el potencial de reposo e inhibiendo el mecanismo accesorio de despolarización prolongada.
Otros aspectos importantes respecto a la recuperación funcional del nervio periférico .
Después de una lesión de un nervio periférico la fisioterapia es fundamental.En primer lugar, hemos de prevenir las complicaciones que podrían obstacularizar el resultado final de la regeneración.Es en esta primera fase donde debemos de aplicar técnicas que mejoren el entorno extracelular para reestablecer el riego sanguíneo,reducir el proceso edematoso y evitar la isquemia prolongada.Mas tarde,y a medida que la recuperación nerviosa progresa,la fisioterapia se adaptará a las deficiencias motoras y sensitivas.Los objetivos para prevenir la aparición de complicaciones serían,mantener un estado óptimo del tejido cutáneo y subcutáneo,conservar las amplitudes articulares para evitar la instauración de rigideces,preservar en lo mejor posible el trofismo muscular y evitar la aparición de una posible algodistrofia simpático refleja.Los medios terapéuticos que utilizamos para prevenir las posibles complicaciones van desde combatir el edema mediante técnicas de drenaje, que sería el responsable de la formación de adherencias y rigideces.Hay que evitar las adherencias,especialmente a nivel de las cicatrices,por otra parte, la pérdida de la elasticidad cutánea se previene mediante masajes para flexibilizar la piel.La movilización pasiva permitirá prevenir la aparición de retracciones capsuloligamentosas se cundarias al desuso y la inmovilización.La movilización pasiva se realizará inmediatamente después de haber preparado la articulación,mediante masajes y agentes físicos que permitan aumentar la flexibilidad de los tejidos blandos periarticulares.Igualmente la movilización pasiva se realiza de distal a craneal,utilizando presas próximas a la articulación afectada.A parte de cumplir la regla de oro de “no dolor” hemos de considerar durante la movilización pasiva en no poner en peligro las suturas realizadas por el cirujano.
Respecto a la recuperación motora se ha observado que se obtiene una activación muscular más eficaz solicitando al músculo en acción excéntrica,aún así, el número de contracciones debe ser limitado y adaptado a la fatiga.La técnica de Kabat, permite a través del desbordamiento de energia, que la contracción de los músculos más fuertes ayuden a solicitar de forma máxima a los músculos más débiles.
Cuando la reinervación está más avanzada, se solicita al paciente realizar trabajos dinámicos de menor a mayor complejidad para devolver las cualidades funcionales perdidas.Hemos de restaurar la coordinación a través del entrenamiento propioceptivo.
La recuperación sensitiva generalmente sigue un orden preciso,,en primer lugar suelen recuperarse primero las fibras de pequeño calibre y poco mielinizadas que corresponden a la sensibilidad de protección, dolorosa y térmica.A continuación,las fibras de los corpúsculos de Meissner superficiales,permiten la sensibilidad a las vibraciones y al contacto.Luego regeneran las fibras de adaptación lenta que corresponden al contacto ligero (células de Merckel).Las fibras de adaptación rápida como los corpúsculos de Pacini suelen recuperarse mucho más tarde (Dellon,1983).
Conclusiones.
Los resultados obtenidos en el tratamiento de neuromas por causas yatrógenas mediante la MPG son excelentes.El paciente a la primera sesión nota una mejoría notable,reduciéndose los puntos tinel y la anestesia dolorosa.
La mejoría del dolor neuropático permite restablecer el equilibrio hemodinámico del simpático.
La respuesta ectópica y efáptica va desapareciendo a medida que mejora la sintomatología dolorosa.
La técnica de MPG es muy eficaz en el tratamiento de neuromas de origen periférico.
Bibliografía:
Bisby MA, Keen P.: Regeneration of primary afferent neurons containing substance P-like immunoreactivity . Brain Res. 1986 Feb 12;365(1):85-95
Chen LE, Seaber AV, Glisson RR, Davies H, Murrell GA, Anthony DC, Urbaniak JR . : The functional recovery of peripheral nerves following defined acute crush injuries. J Orthop Res. 1992 Sep;10(5):657-64.
De Koning P, Gispen WH .: Org.2766 improves functional and electrophysiological aspects of regenerating sciatic nerve in the rat . Peptides. 1987 May-Jun;8(3):415-22.
Dellon AL .: Correlation of histology and sensibility after nerve repair .Journal Hand.Surg.1983,8,871-875.
Fanucci E, Masala S, Fabiano S, Perugia D, Squillaci E, Varrucciu V, Simonetti G .: Treatment of intermetatarsal Morton's neuroma with alcohol injection under US guide: 10-month follow-up . Eur Radiol. 2003 Oct 3.
Fu SY, Gordon T.: Contributing factors to poor functional recovery after delayed nerve repair: prolonged denervation . J Neurosci. 1995 May;15( 5 Pt 2):3886-95.
Hortemo GS, Finsen V.: Surgical treatment of Morton's neuroma :Tidsskr Nor Laegeforen. 2003 Oct 23; 123(20): 2888.
Kauppila T, Stenberg D, Porkka-Heiskanen T .: Putative stimulants for functional recovery after neural trauma: only spermine was effective. Exp Neurol. 1988 Jan;99(1):50-8.
Lallemand B, Care G, Franck T, Magotteaux J .: How I explore ... a Morton's neuroma. Rev Med Liege. 2003 Oct; 58(10): 638-40.
Lindqvist A, Rivero-Melian C, Turan I, Fried K .: Neuropeptide- and tyrosine hydroxylase-immunoreactive nerve fibers in painful Morton's neuromas . Muscle Nerve. 2000 Aug; 23(8): 1214-8.
Lisney SJ.: Functional aspects of the regeneration of unmyelinated axons in the rat saphenous nerve . J Neurol Sci. 1987 Sep;80(2-3):289-98.
Mackinnon SE, Dellon AL, O'Brien JP, Goldberg N, Hunter DA, Seiler WA 4th, Carlton J. Selection of optimal axon ratio for nerve regeneration . Ann Plast Surg. 1989 Aug;23(2):129-34.
Miyamoto Y, Sugita T, Higaki T, Ikuta Y, Tsuge K .: The duration of denervation and regeneration in nerve grafting. Quantitative histological assessment in the rat. Int Orthop. 1985;9(4):271-6.
Ozmen S, Latifoglu O, Ayhan S, Yavuzer R, Nurlu G, Sezer C, Atabay K.: Impact of epineurial excision of the distal recipient nerve in terminolateral neurorrhaphy . J Reconstr Microsurg. 2004 Jul;20(5):385-97.
Sulaiman OA, Midha R, Munro CA, Matsuyama T, Al-Majed A, Gordon T . : Chronic Schwann cell denervation and the presence of a sensory nerve reduce motor axonal regeneration. Exp Neurol. 2002 Aug;176(2):342-54.
Siironen J, Vuorinen V, Taskinen HS, Roytta M . : Axonal regeneration into chronically denervated distal stump. 2. Active expression of type I collagen mRNA in epineurium . Acta Neuropathol (Berl). 1995;89(3):219-26.
Sunderland S . A classification of peripheral nerve injuries producing loss of function. Brain. 1951 Dec;74(4):491-516.
Van Meeteren NL, Brakkee JH, Helders PJ, Gispen WH . : The effect of exercise training on functional recovery after sciatic nerve crush in the rat . J Peripher Nerv Syst. 1998;3(4):277-82.
Vogelaar CF, Vrinten DH, Hoekman MF, Brakkee JH, Burbach JP, Hamers FP .: Sciatic nerve regeneration in mice and rats: recovery of sensory innervation is followed by a slowly retreating neuropathic pain-like syn drome. Brain Res. 2004 Nov 19;1027(1-2):67-72
