Alejandra Ramos*
Lic. en Fisioterapia y Rehabilitación, egresada de la Columbus University de Panamá
Abstract
Complex Regional Pain Syndrome type 1 (CRPS-I) starts with an acute phase of regional neurogenic inflammation that leads to a chronic phase of neuropathic disorders. The involvement of the sympathetic nervous system in its genesis and maintenance is significant, but not exclusive. Consequently, an early and multi-factorial treatment aimed to physiopathological mechanisms is important. Several pathophysiological concepts have been proposed to explain the complex symptoms of CRPS: (i) facilitated neurogenic inflammation; (ii) pathological sym-patho-afferent coupling; and (iii) neuroplastic changes within the CNS. Furthermore, there is accumulating evidence that genetic factors may predispose for CRPS. Therapy is based on a multidisciplinary approach. Non-pharmacological approaches include physiotherapy and occupational therapy. Pharmacotherapy is based on individual symptoms and includes steroids, free radical scavengers, treatment of neuropathic pain, and finally agents interfering with bone metabolism (calcitonin, biphospho-nates). Invasive therapeutic concepts include implantation of spinal cord stimulators. This review covers new aspects of pathophysiology and therapy of CRPS.
Keywords:
Causalgia, complex regional pain syndrome, neuropathic pain, reflex, sympathetic dystrophy, Sudecks dystrophy, sym-pathetically maintained pain, therapy
Resumen
El síndrome doloroso regional complejo tipo 1 (SDRC-I) cursa con una fase aguda de inflamación neurogénica regional, que conduce a una fase crónica de desórdenes neuropáticos. La participación del sistema nervioso simpático en su génesis y mantenimiento es significativa, pero no exclusiva. De ahí la importancia de un tratamiento precoz y multifactorial, dirigido a los mecanismos fisiopatológicos. Algunos conceptos fisiopatológicos han sido propuestos para explicar los síntomas del SDRC-I:1. Una facilitación neurogénica de la inflamación. 2. Un acoplamiento patológico simpático aferente. 3. Cambios neuroplásticos del SNC. La terapia está basada en un abordaje multidisciplinario. La terapia no farmacológica incluye la fisioterapia y la terapia ocupacional. La terapia farmacológica está basada en el uso de esteroides, medicamentos para el dolor neuropático y agentes que inervienes en el metaboliso óseo (calcitonina y bifosfanatos). La tarapia nvasiva incluye la implantación de estimuladores espinales. El artículo cubre los nuevos aspectos de la fisiopatología y terapia del SDRC.
Palabras claves:
Causalgia, síndrome doloroso regional complejo (SDRC), dolor neuropatico, reflejo, distrofia simpática, distrofia de Sudeck, mantenimiento simpático, terapia.
Introducción:
La distrofia simpática refleja (DSR) continúa siendo un desafío para múltiples especialidades médicas. Se define como un dolor difuso, que se localiza habitualmente en zonas periféricas, especialmente en pie o mano, aunque ocasionalmente se presenta en regiones axiales, sea tronco o extremidades y se asocia visualmente a cambios inflamatorios, tróficos y vasomotores en la piel (1). En la Fig. 1 se observa el clásico aspecto inflamatorio, edematoso, brillante, de un pie afectado por una DSR. Se dice que el dolor es difuso, porque en ocasiones migra hacia proximal o bien hacia la extremidad contralateral, como ocurre en este caso.
La Asociación Internacional para el Estudio del Dolor (IASP) define a la DSR, o síndrome doloroso regional complejo, como un síndrome que se desarrolla tras un fenómeno nocivo desencadenante y que se manifiesta por dolor espontáneo o alodinia/hiperalgesia, no limitado a la distribución territorial de un nervio periférico y desproporcionado al episodio desencadenante. En general hay o ha habido edema, anormalidades en el flujo sanguíneo cutáneo o actividad sudomotora anormal, en la región dolorosa del episodio desencadenante.(2)
El diagnóstico precoz es muy importante para la adecuada evolución del paciente. Lamentablemente, en la mayoría de los casos, el diagnóstico por ser eminentemente clínico, se realiza en el momento en el cual la patología ya está instalada.
Esta entidad patológica, tiene una relación con el sistema nervioso simpático, cuya función principal, es la de preparar al individuo para la huída ante estímulos nocivos o adversos. Entonces, cabe preguntar: ¿Qué relación tiene el sistema nervioso simpático en el desarrollo de la DSR? Se ha demostrado que la DSR se desarrolla a partir de un evento traumático (fractura, cirugía, esguince, inmovilización), que genera una injuria importante en algún miembro del cuerpo humano, esto genera un estímulo nocivo (inflamatorio, doloroso y/o infeccioso) que genera una hiperactividad del sistema nervioso simpático, lo cual permite que el dolor se perpetúe en el organismo.
La Fisioterapia, junto con el tratamiento medicamentoso, constituye la piedra angular en la reversión del cuadro.
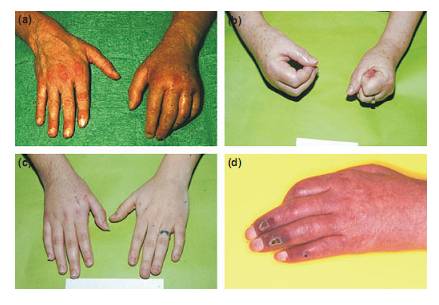
Fig. 1: Trastornos tróficos y autónomos del SDRC
Incidencia
Se ha descrito una incidencia del 1-2% después de varias fracturas, del 2-5% después de lesiones de nervios periféricos, del 7-35% después de fracturas de Colles, 5% en pacientes con IAM, tras lesiones por congelación y tras revascularización de extremidades isquémicas. En un 10-26% de los pacientes no se ha encontrado el factor desencadenante. El 40% de pacientes que requieren la colocación de tutores externos presentan DSR posteriormente. El 38% de los pacientes con material de osteosíntesis desarrollan también la enfermedad (2).
Distrofia Simpático Refleja (Síndrome Doloroso Regional Complejo Tipo I) y Causalgia (Síndrome Doloroso Regional Complejo Tipo II)
El término Síndrome de Distrofia Simpática Refleja, introducido por Evans en la literatura médica en 1946 ha recibido varias denominaciones, todas ellas imprecisas, denotando algunas el origen del trastorno, otras los mecanismos del dolor y otras la evolución del mismo. Así, se le ha llamado: SÍNDROME DE CAUSALGIA (MAYOR Y MENOR), ATROFIA DE SUDECK, ALGODISTROFIA, ALGONEURODISTROFIA, DISTROFIA REFLEJA NEUROVASCULAR, SÍNDROME DE STEINBROCKER, OSTEOPOROSIS POSTRAUMÁTICA, DISTROFIA POSTRAUMÁTICA, VASOESPASMO POSTRAUMÁTICO, EDEMA CRÓNICO POSTRAUMÁTICO, SIMPATALGIA, etc. A partir de 1994 la Asociación Internacional para el Estudio del Dolor (International Association for Study of Pain - IASP, por sus siglas en inglés) reunió todas estas definiciones bajo el término de SÍNDROME DOLOROSO REGIONAL COMPLEJO (SDRC) para denotar el dolor regional y los cambios autonómicos y sensitivos que exceden en intensidad, magnitud o ambos a un fenómeno traumático(2).
Así, el Síndrome Doloroso Regional Complejo quedó clasificado en Tipo-I (Distrofia Simpática Refleja) y en Tipo-II (Causalgia). En este último, el dolor es producido esencialmente por una definida y demostrable lesión del nervio periférico y sus ramas.
DSR o SDRC Tipo I. Manifestaciones Clínicas. Signos y Síntomas.
El primer síntoma asociado a la DSR es el dolor, generalmente descrito como un ardor constante o dolor intenso. Evoluciona hasta convertirse en un dolor crónico y grave y normalmente se inflama la extremidad dañada. En ese momento, el edema se halla localizado en una zona concreta y la piel se hace muy sensible al tacto. La disminución de la función motora y la fuerza muscular están asociadas a la articulación de la extremidad. También pueden presentarse temblores y espasmos musculares. Con el tiempo, la piel puede degenerarse y se pueden empezar a producir cambios en las uñas. La mayoría de los pacientes experimentan un cambio significativo en la temperatura de una extremidad en comparación con la otra. La osteoporosis puede ser detectada en densitometrías óseas y, cuando la inflamación de la zona dañada se pica, aumentan las probabilidades de sufrir infecciones de la piel. En algunos casos, los síntomas se extienden a otras extremidades donde no existe lesión y el trastorno se hace mucho más difícil de controlar. La propagación hacia áreas no dañadas aumenta la dificultad a la hora de diagnosticar y tratar la DSR para un médico que no está familiarizado con esta común característica.
La extremidad afectada tal vez muestra vasoespasmo o vasodilatación, aunque primero se nota dilatación. La mano es rosa, tibia y seca. El trastorno puede progresar luego a vasoespasmo (constricción), al hacerse la mano fría cianótica y húmeda. La progresión a la postre hace que la piel se vuelva brillosa, los músculos sufren atrofia y las articulaciones se hacen rígidas. El paciente prefiere no mover el miembro por causa del dolor intenso, lo cual genera más edema al producirse el estasis venoso y este edema conlleva a mayor limitación de las amplitudes del movimiento articular y a mayor impotencia funcional(3).
En base a lo anteriormente descrito, se ha determinado que la presentación clínica del Síndrome doloroso regional complejo tipo I, lo representa la siguiente triada:
- Trastornos tróficos y autonómicos: Edema distal en un 80% de los casos (4) al igual que los cambios de temperatura (5) que en las primeras 4-5 semanas de la enfermedad, la piel se torna 1°C por encima de la temperatura corporal y en el 40% de los pacientes la temperatura disminuye con el transcurso de la enfermedad (6). Inicialmente, los afectados muestran una extremidad enrojecida, hacia la fase crónica la piel se ve pálida. Un 55% del paciente con SDRC presenta sudoración aumentada en la extremidad afectad o hiperhidrosis lo cual suele ser más común que la hipohidrosis (7). Otro cambio trófico lo representa el crecimiento aumentado de vellos y uñas en las primeras etapas; en la fase crónica, se aprecia atrofia de la piel y de los músculos, así como contractura que puede restringir los movimientos (8).
- Alteraciones sensoriales: Casi el 90% de os pacientes con SDRC refieren síntomas sensoriales (9). Estos trastornos no sólo se limitan al territorio de inervación de un solo nervio, los pacientes suelen referir que el trastorno se muestra como un guante o una media. El dolor y la hiperalgesia son síntomas
- claves del SDRC. Alrededor de un 75% reportan dolor espontáneo que se describe a menudo como dolor punzante, escozor o presión interna. El dolor puede aumentar con la osteoartritis, el movimiento o el estrés nervioso. La alodinia (dolor por el tacto) en uno de los síntomas mayormente descrito por los pacientes que cursan con esta patología (10).
- Disfunción motora: La mayoría de los pacientes refieren debilidad muscular (11). En un principio las amplitudes del movimiento pueden verse afectadas por causa del edema concomitante, en las últimas etapas, por contracturas y fibrosis. Estudios recientes han demostrado que ciertos pacientes han mostrado negligencia del miembro afectado, un 54% de los pacientes de este estudio sintieron su mano como un miembro extraño (12).
Fisiopatología del SDRC tipo I o DSR
Los mecanismos involucrados en el desarrollo de la DSR todavía no están claros. Se postula que existen mecanismos periféricos, como disfunción en la sinapsis primaria o alteración en la respuesta a neurotransmisores (sustancia P y péptidos vasoactivos). Lo más aceptado, tanto por los elementos clínicos como por la respuesta a las terapias, es que existe una sobreactivación del sistema simpático (colocar la referencia de esto, la tengo en mi guía ojo). El proceso se inicia cuando se produce un daño o lesión que provoca un estímulo doloroso, el cual es transportado hacia el sistema nervioso central a través de la médula espinal; luego el estímulo activa al sistema nervioso simpático y regresa al área afectada originalmente, causando una respuesta inflamatoria con vasoespasmo, edema y aumento del dolor, el que nuevamente activa la respuesta simpática, con lo que se establece un círculo vicioso de edema y dolor. Como resultado se produce dolor quemante de la extremidad, aumento de volumen y eritema de la piel en parches. Si bien la fisiopatología de la DSR continúa siendo enigmática, en la actualidad se acepta que el dolor se mantiene debido a la estimulación del sistema nervioso simpático producida por diferentes estímulos, como el herpes zoster, la neuralgia o la neuropatía metabólica (Fig. 2)
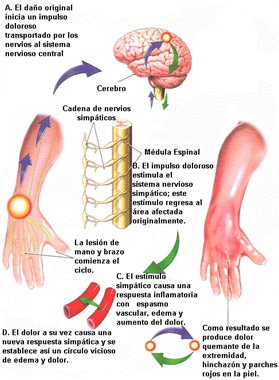
Figura 2. Esquema de la fisiopatología de la distrofia simpática refleja.
Otro aspecto importante que debe ser considerado en la fisiopatología de la DSR, es el hecho de que en algunos de los casos, esta patología se desarrolla luego de una cirugía, la cual se ha hecho necesaria por causa de un traumatismo que produce lesión en algún tejido. Un ejemplo de ello, lo representan las secciones tendinosas por cortaduras complicadas o las fracturas que requieren reducción quirúrgica y la colocación de cierto material de osteosíntesis. Entonces, si el período el paciente en el período post-quirúrgico, desarrolla una infección, esto le predispondrá, en un alto grado a desarrollar una DSR. Esto se debe a que aunado a la hiperactividad del sistema nervioso simpático que ya se ha descrito, el paciente presentará una respuesta inflamatoria concomitante a la infección. Esto genera la producción de interleuquinas proinflamatorias como FNT alfa, IL-1, IL-6, entre otras, producidas por los macrófagos que llegan a la zona de a injuria a fagocitar los agentes patógenos.
Los conceptos fisiopátológicos más recientes demuestran que en la DSR existe el desarrollo de tres procesos claves: Una inflamación neurogénica, una disfunción autonómica y cambios neuroplásicos en el sistema nervioso central.
1. SDRC tipo I. Una inflamación neurogénica
El concepto de inflamación neurogénica incluye el hecho de que distintas clases de fibras C, no sólo tiene una función aferente en la mediación del dolor, sino que también tienen una función neurosecretora eferente (13). Una importancia particular la tienen las fibras C termo-mecánico insensibles (FCT-MI) (14). Estos nociceptores, liberan neuropéptidos vía axonal refleja. Estas fibras C mecano-térmicamente insensibles, han sido denominadas “nociceptores silentes” porque no son excitables por el calor fisiológico o por estímulos mecánicos. No obstante, estas FCT-MI, son activadas y sensibilizadas por mediadores inflamatorios (15). También la sensibilización central, por ejemplo, el desarrollo de hiperalgesia mecánica secundaria, es inducida por las unidades de FCT-MI (16).
En la inflamación neurogénica, los potenciales de acción son retrógradamente por via de ramas colaterales de axones, después de la activación distal de los nociceptores. Existen neuropéptidos, principalmente, la sustancia P y la proteína relacionada con el gen de la Calcitonina (PRGC), son liberados consecutivamente. La sustancia P, produce extravasación de proteínas plasmáticas (edema), sin embargo la PRGC induce a la vasodilatación (eritema e hipertermia) (17). Experimentos que han empleado inducción eléctrica del reflejo axonal de vasodilatación e indicó la liberación de la PRGC (18).Finalmente, otros estudios han mostrado un incremento de los niveles séricos de la PRGC en pacientes con SDRC, la cual se ha normalizado, después de realizar suficiente terapia (19). Niveles elevados de PGRC, también estuvieron asociados a alteraciones autonómicas como el aumento de la sudoración o hiperhidrosis y al crecimiento de vellos, el papel de la sustancia P parece estar implicado en la regulación de la actividad osteoclástica (20).
Las citoquinas, tales como el FNT alfa, aumenta la liberación de neuropéptidos de las fibras C. El receptor soluble de FNT alfa, es responsable del aumento de la hiperalgesia. Asimismo, se ha registrado el aumento de la concentración de citoquinas pro-inflamatorias como la IL-2 y disminución de citoquinas anti-inflamatorias como IL-4 e IL-10 (21).
2. Disfunción Autonómica
Los trastornos manifiestos en el SDRC, apuntan a una participación del sistema nervioso simpático. Diversos estudios han demostrado que estos trastornos dependen del estadío de la enfermedad (22, 23, 24).La hipertermia de la extremidad afectada, no sólo resulta de la inflamación neurogénica, como ya se ha descrito, sino también de la inhibición funcional de la neurona simpática vasoconstrictora, ocurriendo entonces, una vasodilatación consecutiva. En consecuencia, los niveles venosos de noradrenalina son más bajos en el lado afectado (25). La fase crónica de la enfermedad conduce a la piel fría y a la vasoconstricción. Por otra parte, la hipersensibilidad de las estructuras vasculares inervadas, en la extremidad afectada, como consecuencia de la disminución inicial de la actividad simpática, juega un papel importante. En consecuencia, autoradiomediciones gráfica de la piel de pacientes con SDRC, muestran un aumento de la densidad de los receptores alfa-adrenérgicos en la epidermis (26). Tal acoplamiento simpático-aferente, puede representar una condición para el dolor mantenido por mecanismo simpático. Finalmente, la activación masiva de las neuronas vasoconstrictoras en el SDRC, da como resultado un notable incremento del dolor y la hiperalgesia (27). Estos resultados demuestran, que el aumento de la actividad simpática, podría contribuir a una excitación de las fibras nociceptivas y, por tanto, directamente al desarrollo del dolor. Otro mecanismo importante, que conduce a la alteración de la microcirculación local en el SDRC, es la alteración de la función endotelial, con reducción de la vasodilatación inducida por la acetilcolina. (28). Estas alteraciones finalmente, dan lugar a la hipoxia y a la acidosis tisular. Los protones emergentes, son nuevamente potentes agentes que inducen al dolor, causando hiperalgesia en piel y músculos (29). Estas anormalidades, pueden resultar in la producción de radicales libres, locual induce a cambios histológicos por estrés oxidativo.
3. Alteraciones del SNC
Estudios recientes apuntan a un papel crucial del SNS en la fisiopatología del SDRC. No sólo los patrones complejos de la disfunción autonómica, sino también los síntomas motores y sensoriales, implican alteraciones del SNC. Casi todos los pacientes tienen músculos paréticos en el miembro afectado. La paresia no puede ser explicada por medio de edema o contracturas. Típicamente, se restringe el rango activo del movimiento, mientras que a menudo es posible realizar el movimiento pasivo. Puede ocurrir mioclonías o distonías. Alrededor del 50% de los pacientes tienen un aumento en el temblor fisiológico (30). Más aún, el patrón de los déficits sensoriale (una distribución como de guante o media), no está .limitado a territorio de un sólo nervio periférico. También se ha reportado pérdida hemisensorial. Estos hallazgos sirvieron como punto de partida para otros varios estudios que utilizan la imagen funcional como técnica de reeducación del movimiento. Se han examinado la extensión de la representación cortical de la mano en la corteza somatosensorial primaria comparando el lado sano con el lado afectado por el SDRC. Sorprendentemente, la región que representa la mano con SDRC, dentro de la corteza contralateral, había disminuido dramáticamente (Fig. 3a) (31). La cantidad de reorganización fue correlacionada positivamente con el alcance de la hiperalgesia mecánica y la intensidad del dolor del SDRC. En otro estudio, ha podido demostrar que los cambios corticales son reversibles bajo un adecuado tratamiento (fig.3b). La reorganización central es evidencia de las alteraciones somatotróficas de pacientes con dolor del miembro fantasma. Las alteraciones del SNC, podrían explicar los complejos síntomas sensoriales (Ej: La parestesia guante/ media, la sensación de mano extraña o ajena, la falta de ubicación tras una estimulación táctil, la disfunción de la capacidad de aprendizaje perceptual). Una falta de reorganización, podría ser un factor importante para la cronificación del dolor
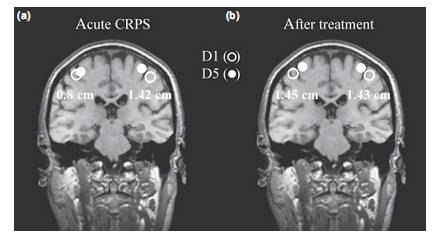
Fig. 3. Reorganización cortical en SDRC. En este caso la mano izquierda está afectada. (a) La exrensión cortical de la mano (distancia entre el 1° y 5° dedo D1 y D5) en estado agudo disminuye a 1,42 cms en el lado sano y a 0,8 cms en el lado afectado. Alteraciones somatotróficas relacionadas con la alteración dolorosa. (b) Normalización después de 1 año de tratamiento con terapia. (31)
Más aún, se mostrado en un estudio utilizando RM que el procesamiento cortical de los estímulos mecánicos en el lado con SDRC hiperálgésico, es sustancialmente diferente de la activación durante una estimulación idéntica en el lado sano. Se ha demostrado particularmente, un aumento en la activación en las áreas cerebrales relacionadas al procesamiento del dolor afectivo-motivacional, es decir, principalmente en la corteza frontal (fig. 4) (32). Finalmente, los apacientes con SDRC, muestran una reorganización significativa de los circuitos motores centrales, con un aumento de la activación de la corteza motora primaria, la parietal y la motora suplementaria durante la percusión de los dedos. Adicionalmente de estos estudios por RM, hay estudios psicofísicos que demuestran que muchos pacientes con SDRC padecen síntomas similares a la negligencia motora. En resumen, hay evidencias crecente de que las alteraciones del SNC, juegan un papel importante en el desarrollo del SDRC
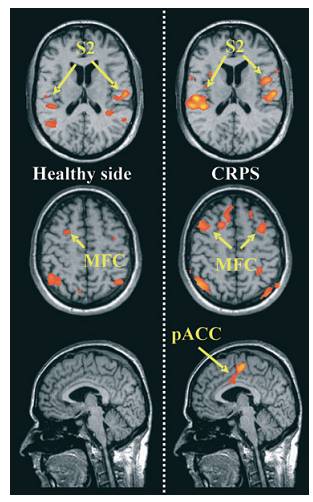
Fig. 4. Imagen de RM durante la estimulación por mecanismo no doloroso del cerebro. (a) lado hiperalgésico afectado por SDRC. (b) Alta activación somatosensorial cortical secundaria (S2), medio de la corteza frontal y parte posterior de la corteza cingular anterior durante la hiperalgesia mecánica. (32)
ESTADIOS DE LA EMFERMEDAD.
En la actualidad se reconocen tres estadios dentro de la DSR, también llamada síndrome de dolor regional complejo:tipo 1, 2 y 3. Esta patología se puede pesquisar en cualquiera de estos estadios. La primera etapa es precoz, inmediatamente posterior al trauma y se caracteriza por una respuesta inflamatoria aguda, sin signos de atrofia. Todavía no está claro qué determina la resolución espontánea de la enfermedad en algunos pacientes en etapa 1, mientras otros progresan rápidamente a la siguiente etapa. La DSR tipo 2 se caracteriza por importantes cambios distróficos de la piel, secundarios a lesión del nervio periférico y sus ramas, es decir, la causalgia. La DSR tipo 3 es una etapa atrófica y difícilmente reversible; se caracteriza por atrofia marcada, rigidez difusa y mayor compromiso neurológico (Fig.5). En resumen, existe suficiente evidencia de que existe una facilitación neurogénica en la inflamación en el SDRC. (33)
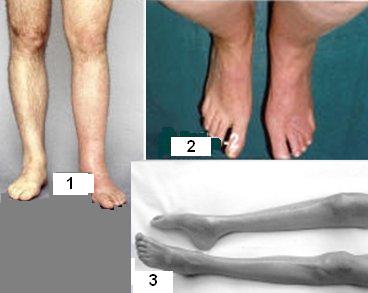
Figura 5. Etapas 1, 2 y 3 de la distrofia simpática refleja
AGENTES CAUSALES
Si bien el mecanismo de la DSR es aún oscuro, obviamente participa en esta afección el sistema nervioso simpático. El DOLOR es el agente causal primario, al ser secundario todos los demás cambios tisulares. El paciente susceptible suele mostrar un umbral bajo al dolor e inestabilidad emocional. La lesión causa infiltración de exudado en los tejidos, exudado que no puede removerse porque el paciente evita todo tipo de movimiento. La INACTIVIDAD (inmovilidad), se convierte en el factor causal secundario. La congestión venosa adicional y el estasis linfático, producen organización postrera del exudado rico en proteínas. Ocurre fibrosis, edema crónico y osteoporosis. El ciclo se perpetúa a si mismo, mientras que persiste el dolor que causa la inactividad.
Si a esto se le une, la colocación de un yeso o una férula muy ajustada u en una posición extrema del miembro, el cuadro se agravará por cuanto el estímulo doloroso se mantiene en el tiempo lo que implicará una mayor reactividad del sistema nervioso simpático, con un peor pronóstico de la enfermedad. De aquí radica la importancia de vigilar adecuada y cuidadosamente, el estatus post-quirúrgico del paciente, de manera de controlar eficientemente estas variables y disminuir a como dé lugar, todo factor de riesgo que puedan complicar la condición del paciente.
DIAGNOSTICO
Los grandes 4 criterios diagnósticos son
1 -Dolor y sensibilidad de una extremidad.
2- Síntomas o signos de inestabilidad vasomotora:
- Fenómeno de Raynaud.
- Piel fría o pálida.
- Piel caliente o eritematosa.
- Hiperhidrosis.
3- Tumefacción de la extremidad: Edema con o sin fóvea.
4- Cambios tróficos de la piel:
- Atrofia.
- Descamación.
- Hipertricosis.
- Pérdida de pelo.
- Cambios ungueales.
- Engrosamiento de aponeurosis palmar.
Interpretación
- Definida: si cumple los 4 criterios.
- Probable: si cumple los criterios 1, 2 y 3.
- Posible: si cumple los criterios 1 y 2. (34)
TRATAMIENTO
Terapia Física:
La rehabilitación es de vital importancia en la resolución del SDRC. Por causa del dolor intenso, el paciente con esta patología anula el miembro afectado, dejando de moverlo y usarlo en sus actividades cotidianas. El fisioterapeuta deberá tener una cautela extrema al realizar las terapias, ya que si éstas son intensamente dolorosas, el sistema nervioso lo asumirá como otro estímulo nocivo y ayudará a perpetuar aún más el dolor. Es por esto que en fase aguda donde la alodinia es preponderante, los objetivos terapéuticos deberán estar enfocados a la analgesia con uso de corriente (TENS o corriente Diadinámica), control del edema y evitar retracciones con movilizaciones pasivas a tolerancia, evitando el dolor extremo.
Es importante, que la fisioterapia se enfoque a la reeducación muscular. Para ello, el paciente deberá realizar ejercicios los cuales se inician con movimientos libres que buscan amplitud del rango articular. En la medida en que la distrofia retrocede, los ejercicios podrán ir progresando hacia la resistencia y las movilizaciones pasivas hacia los rangos articulares completos, de esta manera, evitaremos la atrofia muscular con la consecuente rigidez y limitación. (35)
En ocasiones, cuando el paciente presenta negligencia del miembro afectado, la terapia con espejo es de gran utilidad. La misma consiste en colocar al paciente frente a un espejo donde sólo vea la mitad de su cuerpo sano, deberá mover el miembro afectado y mirar cada movimiento de manera de que el cerebro perciba el movimiento normal.
La hidroterapia en fase aguda es de gran utilidad. El miembro afectado del paciente flotará dentro del agua y al no haber ningún tipo de resistencia, el paciente podrá realizar los movimientos con mayor facilidad. En los casos de hipertermia, el agua fría es muy útil.
En la fase crónica, la hiperalgesia tiende a desaparecer, entonces, es en esta fase donde las movilizaciones pasivas forzadas/progresivas pueden ayudar a mejorar el movimiento. El uso de férulas posicionadoras es de gran utilidad, ellas permiten mantener a las articulaciones en las posiciones que queremos mejorar para corregir las deformidades (en flexión o en extensión).
Medicación
Para tratar el dolor, utilizaremos analgésicos, antiinflamatorios no esteroideos (AINES), aunque se consideran poco eficaces, con probable excepción del tramadol.
La utilización de Corticoides sistémicos es controvertida, aunque algunos autores los utilizan en las formas politópicas a dosis de: prednisona 30-40-60 mg/ día, en dosis repartidas efectuando una reducción gradual de la dosis en 2-4 semanas. Otros autores consideran esta terapia efectiva a corto y largo plazo (un año), a dosis de 30 mg/día con disminución progresiva hasta un máximo de unas 12 semanas; mientras que otros la utilizan a dosis de 60-50-40 mg día según la severidad clínica y con descenso escalonado de la dosis durante 17-25 días, siendo necesaria una segunda tanda en un escaso número de pacientes (1, 2, 3 y 5 meses), con resultados igualmente satisfactorios.
Los Antidepresivos tricíclicos (Amitriptilina) , a dosis de 10-25 mg/ día, son útiles en todas las fases de esta enfermedad, especialmente si el dolor es constante, espontáneo o paroxístico De igual modo, puede resultar útil la Clomipramina 75-150 mg/día. También podemos utilizar doxepina, Trazodona, nortriptilina e inhibidores selectivos de la recaptación de la serotonina (en general, parecen menos eficaces que la Amitriptilina). Precisan al menos de unas 4 semanas para que su efecto sea máximo. Muchos de estos pacientes presentan ansiedad e insomnio asociado, tanto por la misma enfermedad, como por cierta medicación que reciben, por lo que será favorable administrarles además ansiolíticos. Hay autores que sugieren la escasa eficacia de todos estos fármacos en el tratamiento del dolor neuropático asociado al SDRC, pero otros reconocen su importancia en la práctica clínica.
La Gabapentina a dosis 900- 1800 mg/ día, puede ser útil en dolores espontáneos y paroxísticos. Se ha utilizado también, en pacientes con síntomas persistentes de SDRC durante un periodo de un año, con resultados satisfactorios. Siendo considerado por otros facultativos su efecto analgésico como moderado, y es considerado más efectivo cuando se utiliza conjuntamente con mórficos, precisando de estudios más numerosos y prolongados que lo confirmen. Otros, como la Carbamacepina tiene un efecto menos favorable (mientras que es considerado por otros efectivo a dosis de 600 mg/día). La pregabalina también resulta eficaz para tratar el componente de dolor neuropático, al igual que el topiramato, pero no hemos encontrado estudios específicos para el SDRC.
Los mórficos, fundamentalmente Morfina o Fentanilo, se reservarán para dolores severos tanto agudos como crónicos.
Puede ser beneficiosa en algunos pacientes, durante el estadio agudo de la DSR, la utilización tópica de capsaicina aplicada 4 veces al día, pero para demostrar que tiene eficacia deberemos esperar unas cuatro semanas.
La clonidina (10 mg/día) en parches, puede servir para reducir la hiperpatía local.
La lidocaína al 5% en parches, parece ser una terapia coadyuvante adecuada, pero precisa de mayor investigación. También existe una presentación en crema que contiene 25 mg de lidocaína y 25 mg de prilocaína, pudiendo proporcionar varias horas de analgesia.
El Dinitrato de Isorbida se ha utilizado en un pequeñísimo estudio con 5 pacientes, aplicando 1gr de ungüento que contiene 1% (10 mgr) cuatro veces al día durante 10 semanas, con moderado efecto sobre el dolor, y con algún efecto secundario a su absorción sistémica, por lo que será preciso un estudio con un número mayor de pacientes para evaluar realmente su eficacia.
Para tratar los espasmos y distonía, podemos utilizar el Baclofeno (50-75 μg intratecal), pudiendo ser menos efectivo en los pies que en las manos. También se utiliza en clonazepam.
El Nifedipino (10-30 mg/ día), puede ayudar a reducir el dolor relacionado con la alteración vascular que produce este proceso.
El propanolol a dosis de unos 40 mg/dos veces al día, puede ser de utilidad para bloquear los receptores simpáticos. Otros utilizan los bloqueantes del sistema adrenérgico como la fenoxibenzamina (FBZ). Se ha publicado un estudio con 4 pacientes tratados con FBZ, con resultados satisfactorios en la mayoría de ellos, utilizando 10 mg/día durante meses, siendo necesaria la vigilancia de efectos secundarios que pueda ocasionar (hipotensión , taquicardia, problemas sexuales en el varón como la inhibición de la eyaculación, congestión nasal, miosis; y en menor frecuencia confusión, somnolencia, sequedad de boca, fatiga, cefalea e irritación gastrointestinal), y en caso de aparecer disminuir la dosis de esta medicación y/o tomarla más espaciada en el tiempo (por ejemplo cada 2-3 días o más), siendo una alternativa más en pacientes refractarios a otros tratamientos.
La Calcitonina se ha utilizado con buenos resultados. Inicialmente la administraremos inyectada a dosis de 100 U/día, durante 4-8 semanas, seguido de otras 4-8 semanas a días alternos. Se administrará a las cuatros horas suplementos de 600 mg/día de calcio y 400 U.I de vitamina D. Otros autores, la prescriben por vía intranasal 100-200 UI/día durante 2 meses. Su utilización es controvertida, así hay autores que la consideran inefectiva y otros afirman su eficacia en el tratamiento del SDRC. [B]
Los bifosfonatos como el pamidronato endovenoso, a dosis de 30-60 mg/día, durante tres días seguidos, ha demostrado su eficacia en un plazo de 90 días. Otros autores la utilizan a dosis de 60 mg, repitiéndola a los 2 y 4 meses. También se ha comunicado buenos resultados con el clodronato, a dosis de 300 mg ev/día durante 10 días o con alendronato 7,5 mg ev durante 3 días consecutivos, otros utilizan el alendronato a dosis de 40 mg/día oral durante 8 semanas, con mejoría tanto del dolor como de la movilidad. Estos fármacos han demostrado su eficacia clínica a largo plazo (4 semanas a 180 días). [A]. Sin embargo, la última revisión sistemática de estos tratamientos (abril de 2008) les reconoce su potencial terapéutico para reducir el dolor, aunque los autores del artículo concluyen que no existen pruebas suficientes para recomendar su empleo en la práctica clínica, precisándose de más estudios con criterios de mayor calidad para que se pueda justificar su empleo habitual.
En Holanda se utiliza como terapia estándar, el dimetilsulfóxido (DMSO) al 50% en crema, aplicada 5 veces al día, y la acetilcisteina 600 mg 3 veces al día. Se han realizado estudios coste-efectividad y coste-utilidad durante 52 semanas, con resultados similares, aconsejando por su eficiencia y comodidad el DMSO. Sin embargo, el DMSO parece más eficaz en la fase caliente del SDRC y en especial si se afectan los miembros inferiores, y la acetilcisteina parece más apropiada para tratar el SDRC en fase fría y si están afectados los miembros superiores. Hay autores que consideran que el DMSO es eficaz para los síntomas inflamatorios, pero sin alivio significativo del dolor.
La talidomida, se ha utiliza con éxito, en pacientes que presentan esta enfermedad durante años, cuando han fracasado otras terapias, a dosis de 200 mg/ día, aumentándola a 400 mg/ día después de haber transcurrido dos semanas, apreciándose respuesta evidente alrededor de unas 4-6 semanas, y con dosis de mantenimiento de 100 mg/dia. Este tipo de tratamiento esta todavía sujeto a un estudio multicéntrico, para que pueda corroborar su utilidad con las suficientes garantías para su aplicación como terapia alternativa frente al SDRC.
Inhibidores de la N-Metil-D-Aspartato (NMDA), como la Memantina resulta efectiva por vía oral a dosis iniciales de 5 mg/día con aumento de 5 mg cada dos dias, hasta alcanzar los 30 mg/dia repartida en dos tomas cada 12 horas durante 8 semanas; la Ketamina también parece ser efectiva para el tratamiento del SDRC, en casos refractarios a los tratamientos convencionales, pero en ambos casos existe un escaso número de pacientes estudiados, siendo necesario la realización de estudios multicentricos para confirmar estos resultados.. Otros como la amantadina y el dextrometamorfano carecen de estudios para el SDRC.
En casos complicados se utilizan por vía epidural: clonidina, mórficos, bupivacaína, baclofeno y ziconotida con resultados positivos, pero que precisan ser evaluados en el tiempo por el pequeño número de enfermos incluidos.
Bloqueos y simpatectomía
El bloqueo nervioso regional (Clonidina, bretilio más lidocaína), se planteará su realización cuando el tratamiento rehabilitador y farmacológico durante un tiempo inferior a 6 meses no proporcione ningún beneficio, o cuando después de un tiempo superior a 6 meses, no obtenemos un resultado satisfactorio. También, podemos plantear con anterioridad la utilización de estas técnicas, cuando se trate de cuadros inicialmente más graves, de comienzo más extenso y prurifocal. El bloqueo simpático proporciona en la mayoría de los pacientes una respuesta rápida y eficaz frente al dolor, permitiendo una movilización activa y rápida, siendo necesario una serie de tres a seis bloqueos, para conseguir una buena respuesta terapéutica, aumentando la duración del alivio del dolor con cada bloqueo aplicado. Su eficacia a corto y largo plazo no está claramente demostrada, pero hay quien considera que los mejores resultados se obtienen cuando esta técnica se utiliza precozmente, conjuntamente con la terapia física. Hay autores que utilizan los bloqueos simpáticos con bupicaína conjuntamente con Amitriptilina, a dosis de 10-25 mg/ día, incrementando hasta 75-100 mg/ día según respuesta clínica, con aparentes buenos resultados, pero con un escaso número de pacientes estudiados.
De no controlar el dolor se requerirá la realización de una simpatectomía química o quirúrgica, la cual se puede realizar mediante laparoscopia, pero no está exenta de complicaciones como neuralgias (precisando para su resolución de 1-3 bloqueos simpáticos), perturbar otras sensaciones corporales y alterar el control intestinal y genitourinario, neumotórax, síndrome de Horner, por lo tanto, su éxito en su conjunto es variable e imprevisible. Debe ser considerada muy cuidadosamente en lo que se refiere a su utilidad, efectividad y riesgo potencial de efectos adversos. A pesar de lo expuesto, son terapias con resultados contradictorios y posiblemente a evitar debido a su pobre evidencia y eficacia, y alta probabilidad de efectos adversos.
Estímulo del cordón espinal
Consideraremos la estimulación eléctrica medular si tras unos 6 meses de tratamiento rehabilitador y/o tras bloqueo simpático, no se han conseguido resultados satisfactorios. Es una técnica que pueden conllevar riesgos (34%), aunque hay autores que tras una selección cuidadosa de pacientes la consideran segura. Reduce el dolor en un 50-60% de los casos, consideración modesta por algunos autores y mantenida a largo plazo (2 años), pero sin mejoría funcional del paciente, pero otros autores comentan que en un 40% de los pacientes existe una recuperación de estas circunstancias y con capacidad de volver al trabajo, aunque en un 17% deben cambiar su tarea habitual. Está reservada para pacientes muy invalidados, y con ella se intenta mejorar su calidad de vida, existiendo evidencia en este sentido.
Preventivo
En las causas traumatológicas u ortopédicas procurar una movilización lo más rápida y precoz posibles. Parece que podría ser de utilidad la administración de vitamina C, a dosis de 500 mg al día, durante unos 2 meses, en pacientes que han sufrido una fractura o herida sugestiva de desarrollar esta enfermedad.
Terapia de apoyo
Prestar en todos los casos un tratamiento psicológico apropiado a las características de cada individuo, y en especial a los pacientes que sufren una evolución más adversa.
CONCLUSIONES
- El SDRC es una entidad patológica que representa un desafío para el personal de la salud.
- Es una enfermedad altamente discapacitante durante la cual la afección del paciente no es sólo somática sino psíquica.
- El Dx precoz, favorece el pronóstico.
- Es originado por un evento traumático que puede estar acompañado o no de la cirugía y/o infección.
- El dolor como estímulo nocivo desencadena el cuadro.
- Diversos estudios han comprobado la participación del sistema nervioso simpático como elemnto sin ecua non para el mantenimiento del dolor.
Se requiere de un abordaje en el cual participe todo un equipo multidisciplinario para lograr la mejor evolución del paciente.
REFERENCIAS
1) Cervello S. Monzoni M. de la Concepción y L. Alberth. La seudoartrosis de Giristone en el tratamiento de infecciones profundas de la protesis total de cadera. Revista de Ortopedia y Traumatología 1988.
(2) Friberg K.S.I. Themodelino after distal forear fractures. Acta Orthop 1979.
(3) Kleiner B. and Mankin. H.J. Fracture of the lateral portion of the distal tibial epihysis J. Bone Joint. Suro. 1964.
(4) Michaus J.R. Patología Quirúrgica - Traumatología Ortopedia 1981.
(5) Valls J. Perruelo N. Atello C. Kohn Tebner A. Carnevalle V. Ortopedia y Traumatología 1982
(6) Groeneweg G, Niehof S, Wesseldijk F, Huygen FJ, Zijlstra FJ. Vasodilative effect of isosorbide dinitrate ointment in complex regional pain syndrome type 1. Clin J Pain. 2008 Jan;24(1):89-92. [PubMed]
(7) Harden RN, Bruehl S, Stanton-Hicks M, Wilson PR. Proposed new diagnostic criteria for complex regional pain syndrome. Pain Med. 2007 May-Jun;8(4):326-31. [PubMed]
(8) Hettne KM, de Mos M, de Bruijn AG, Weeber M, Boyer S, van Mulligen EM, Cases M, Mestres J, van der Lei J. Applied information retrieval and multidisciplinary research: new mechanistic hypotheses in Complex Regional Pain Syndrome. J Biomed Discov Collab. 2007 May 4;2(1):2. [PubMed] [Texto completo]
(9) Inchiosa MA Jr, Kizelshteyn G. Treatment of Complex Regional Pain Syndrome Type I With Oral Phenoxybenzamine: Rationale and Case Reports. Pain Pract. 2008; 8(2):125-32. [PubMed]
(10) Kiefer RT, Rohr P, Ploppa A, Dieterich HJ, Grothusen J, Koffler S, Altemeyer KH, Unertl K, Schwartzman RJ. Efficacy of Ketamine in Anesthetic Dosage for the Treatment of Refractory Complex Regional Pain Syndrome: An Open-Label Phase II Study. Pain Med. 2008 Feb 5. [PubMed]
(11)Ordu Gokkaya NK, Karakus D, Oktay F, Ucan H. Complex regional pain syndrome (CPRS type I) after a burn injury of the hand. Rheumatol Int. 2008 Mar 18. [PubMed]
(12) Schurmann M, Zaspel J, Lohr P, Wizgall I, Tutic M, Manthey N, Steinborn M, Gradl G. Imaging in Early Posttraumatic Complex Regional Pain Syndrome: A Comparison of Diagnostic Methods. Clin J Pain. 2007 Jun;23(5):449-457. [PubMed]
(13) Taha R, Blaise G. Is complex regional pain syndrome an inflammatory process? Theories and therapeutic implications/Le syndrome douloureux regional complexe est-il un processus inflammatoire ? Theories et implications therapeutiques. Can J Anaesth. 2007 Apr;54(4):249-253. [PubMed] [Texto completo]
(14) Thomson McBride AR, Barnett AJ, Livingstone JA, Atkins RM. Complex regional pain syndrome (type 1): a comparison of 2 diagnostic criteria methods. Clin J Pain. 2008 Sep;24(7):637-40. [PubMed]
(15) Vladimir Tichelaar YI, Geertzen JH, Keizer D, Paul van Wilgen C. Mirror box therapy added to cognitive behavioural therapy in three chronic complex regional pain syndrome type I patients: a pilot study. Int J Rehabil Res. 2007 Jun;30(2):181-8. [PubMed]
(16) Wesseldijk F, Fekkes D, Huygen FJ, van de Heide-Mulder M, Zijlstra FJ. Increased plasma glutamate, glycine, and arginine levels in complex regional pain syndrome type 1. Acta Anaesthesiol Scand. 2008 May;52(5):688-94. [PubMed]
(17) Zollinger PE, Tuinebreijer WE, Breederveld RS, Kreis RW. Can vitamin C prevent complex regional pain syndrome in patients with wrist fractures? A randomized, controlled, multicenter dose-response study. J Bone Joint Surg Am. 2007 Jul;89(7):1424- [PubMed]
(18) Weber M, Birklein F, Neundorfer B, Schmelz M. Facilitated neurogenic inflammation in complex regional pain syndrome. Pain 2001; 91: 251–257
(19) Birklein F, Schmelz M, Schifter S, Weber M. The important role of neuropeptides in complex regional pain syndrome. Neurology 2001; 57: 2179–2184
(20) Frutos S, Ruiz M. Síndrome de dolor regional complejo tipo I o distrofia simpático refleja. En: Manual práctico de dolor. Madrid: Apolonio Morales; 2003: 142-52.
(21) Pérez RS, Zuurmond WW. The treatment of complex regional pain syndrome type I with free radical scavengers: a randomized controlled study. Pain. 2003; 102(3): 297-307.
(22) Wasner G, Heckmann K, Maier C, Baron R. Vascular abnormalities in acute reflex sympathetic dystrophy (CRPS I): complete inhibition of sympathetic nerve activity with recovery. Arch Neurol 1999; 56: 613–620.
(23) Wasner G, Schattschneider J, Baron R. Skin temperature side differences – a diagnostic tool for CRPS? Pain 2002; 98: 19–26
(24) Wasner G, Schattschneider J, Heckmann K, Maier C,Baron R. Vascular abnormalities in reflex sympathetic dystrophy (CRPS I): mechanisms and diagnostic value Brain 2001; 124: 587–599.
(25) Harden RN, Bruehl S, Burton A, Swan M, Costa BR, Barthel J, et al. Complex Regional Pain Syndrome: Treatment Guidelines. RSDSA PRESS MILFORD, CT, June 2006. Disponible el 16/7/2006 en: https://www.rsds.Org/3/clinical_guidelines/index.html.
(26) Duna CT, Martín CW, Noertjojo K. Complex Regional Pain Syndrome. Towards the development of Diagnstic Criteria and Treatment Guidelines. Eviden-ce Based Practice Group. 19 june 2006. https://www.worksafebc.com/health_care_providers/re-lated_information/evidence_based_medicine/de-fault.asp.
(27)Garrido B. Síndrome doloroso regional complejo. Un acercamiento entre fisiopatología y terapéutica. Disponible en: https://revista.sedolor.es/articulo.php?ID=50
(28) Rodríguez , R.F.; Bravo , LE.; Tovar, M.A.; Castro, F.; Ramos, G.E.; Daza, P.;
Determinación de la eficacia analgésica de los bloqueos del ganglio estrellado en el síndrome doloroso regional complejo con dolor mediado por el sistema nervioso simpático: estudio preliminar Disponible en: https://revista.sedolor.es/articulo.php?ID=431
(29) Rodríguez-Hernández , J L ; Dolor osteomuscular y reumatológico . Disponible en: https://revista.sedolor.es/articulo.php?ID=88
(30) Kidd BL, Urban LA. Mecanismos del dolor inflamatorio. Br J Anaesth. 2001; 87(1): 3-11.
(31) Manejo del dolor crónico y limitación en las actividades de la vida diaria González-Rendórí', C; Guadalupe Moreno-Monsiváis , M ; Disponible en: https://revista.sedolor.es/articulo.php?ID=509
(32) Ketamina en el dolor del miembro fantasma. Mayo Moldes , M. ; Carregal Rañó , A. ; Fernández Rodríguez , T Disponible: https://revista.sedolor.es/articulo.php?ID=651.
(33) Síndrome de dolor regional complejo: factores etiológicos, clínicos, radiológicos y escintigráficos Rodrigo , M D ; Perena , M J ; Guillén , J ; Azcona , J ; Mur , P ; Sola , J L Disponible en: https://revista.sedolor.es/articulo.php?ID=154
(34) Avances en el diagnóstico y tratamiento del dolor simpático
Robaina, F. J.; Miranda, G.; Disponible en; https://revista.sedolor.es/articulo.php?ID=304)
(35) Medrano B. Manual de Electroterapia - Rehabilitación Volumen 1 Tomo 1 2000
