Rosario Rocha - Fisioterapeuta
ÍNDICE
Introducción
Proceso de cicatrización normal
Fases de la cicatrización
Composición de las cicatrices
Factores que intervienen en la cicatrización
Cicatrización patológica
Tratamiento
Estudio científico
Método experimental
Resultados
Discusión de los resultados
Conclusiones
Bibliografía
INTRODUCCIÓN
La piel es un órgano extenso, indispensable y complejo que nos protege de las agresiones externas, participando también en mecanismos que regulan el medio interno. Cualquier injuria ocasionada en su superficie induce un conjunto de fenómenos que llevan a la cicatrización de los tejidos dañados, resultando en una cicatriz más o menos perfecta.
El mecanismo preciso de la cicatrización siempre ha sido un misterio, que ahora se esta entendiendo. Es regulado por señales bioquímicas muy complejas, que impulsan moléculas efectoras a actuar en el momento preciso. Este sistema complejo, es muy vulnerable y cualquier señal anómala puede inducir una cicatrización anormal, dando lugar a la formación de cicatrices hipertróficas y queloides.
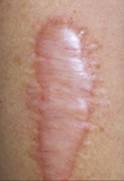
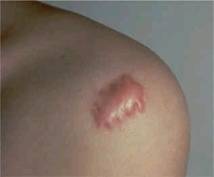
Los queloides y cicatrices hipertróficas son pues, el resultado de una proliferación benigna del tejido fibroso dérmico, normalmente como resultado de una exagerada respuesta tisular a un traumatismo dérmico o enfermedad (tatuajes, quemaduras, inyecciones, vacunas, mordeduras, acné, abscesos o cirugía) en sujetos predispuestos.
Estas lesiones pueden tener implicaciones estéticas y funcionales, siendo la causa básica, todavía, desconocida.
Ninguna modalidad terapéutica es la mejor opción por sí sola, siendo imprescindible poner el énfasis en la prevención, sobretodo en los casos de mayor riesgo.
El criterio de elección de uno u otro tratamiento depende del tipo de cicatriz y de la experiencia del especialista, valorando siempre la relación entre beneficios y riesgos. Hay algunas terapias que, presentando innumeras ventajas frente a efectos secundarios mínimos, no son tan valoradas en la practica clínica por los facultativos, entre otros motivos, talvez, por la insuficiente investigación científica que las avala. Hablamos de técnicas físicas aplicadas por fisioterapeutas con un componente mecánico importante, como los ultrasonidos o el masaje.
La presión aplicada a la cicatriz ( usualmente por medio de ropa o vendajes ) ha sido la medida conservadora más aplicada durante las tres ultimas décadas, desde que se empezó a observar que las cicatrices se volvían menos gruesas después de la aplicación de medias elásticas en pacientes quemados.
Varios son los estudios que muestran la eficacia de esta terapia. El presente artículo se basa en los resultados obtenidos por un equipo de investigadores franceses para constatar la eficacia de esta modalidad terapéutica y reflexionar también, paralelamente, sobre los otros tipos de fuerzas mecánicas que, a pesar de la escasez de estudios concluyentes sobre la remodelación que producen en los tejidos, son utilizadas por muchos fisioterapeutas en centros de rehabilitación con la obtención de resultados, muchas veces, bastante satisfactorios.
PROCESO DE CICATRIZACIÓN NORMAL
Cuándo se ha producido la lesión, comienza la cicatrización normal de la herida, a menos que haya interferencias por factores que enumeraremos más adelante.
FASES DE LA CICATRIZACIÓN
Aunque la cicatrización de la herida se describe, por lo general, cómo una sucesión de fenómenos independientes, en realidad se trata de un conjunto de fases que se solapan en el tiempo.
La denominación y el número de las fases que componen este proceso varían según el autor. Seguidamente procederé a describir, de un modo muy resumido, los principales acontecimientos que ocurren durante la cicatrización, ordenándolos según el criterio que los agrupa en cinco fases: hemostasia, inflamación, proliferación, remodelación y contracción.
Hemostasia
El primer paso del organismo ante una injuria es la formación de un coágulo de sangre que tapone los vasos sanguíneos lesionados para impedir la contaminación bacteriana y la salida de fluidos. Se produce una retracción de los bordes de la herida y contracción tisular. Los vasos presentan una vasoconstricción refleja intensa durante 10 minutos. Las plaquetas comienzan a agregarse y los factores de la coagulación activan la cascada de la coagulación. El coágulo proporciona una matriz provisional, a través de la cuál se produce la migración de células inflamatorias.
Las plaquetas secuestradas liberan una serie de factores de crecimiento, entre los cuáles se encuentra el factor transformador de crecimiento ? ( TGF- ? ), que inducen el reclutamiento de células inflamatorias, la formación de matriz y la neovascularización. Es la fase más corta, no sobrepasando las primeras 5 horas después de la lesión.
Inflamación
Una vez lograda la hemostasia, se liberan aminas vasoactivas en la región de la herida, que producen la dilatación de los capilares no lesionados y el inicio de la exudación de la herida.
Los neutrófilos llegan a la zona, tras una gran variedad de señales quimiotácticas, e inician la fagocitosis. Los monocitos actúan amplificando y controlando la respuesta inflamatoria. Tan pronto como los monocitos circulantes entran en la herida se activan y se convierten en macrófagos, los cuáles continúan destruyendo bacterias, desbridando la herida, y secretando citoquinas y factores de crecimiento indispensables para el proceso de cicatrización. Modulan la acción de los queratinocitos para la epitelización, de los fibroblastos para la formación de matriz celular y de las células musculares lisas y células endoteliales para la angiogénesis.
Otras células inflamatorias implicadas en la cicatrización son los linfocitos, células plasmáticas y mastocitos.
Este periodo se caracteriza clínicamente por calor, rubor, tumor y dolor y dura una media de 5 días.
Proliferación
Tras la fase inflamatoria, llega la fase de proliferación celular. El número de macrófagos desciende y otras células como los fibroblastos, células endoteliales y queratinocitos comienzan a sintetizar nuevos factores de crecimiento que seguirán estimulando la proliferación.
La epitelización comienza rápidamente tras la agresión y dura hasta el tercer día aproximadamente . Los queratinocitos migran desde áreas vecinas ( folículos pilosos y glándulas anexas) y proliferan, restaurando así el epitelio. Los restos de tejido, la fibrina y los leucocitos forman una costra por debajo de la cual ocurre la epitelización
Los fibroblastos adyacentes a la herida comienzan a proliferar y migran hacia ésta, dónde depositan matriz extracelular. A medida que se produce el tejido de granulación, y una vez que se ha depositado una cantidad abundante de colágeno, la celularidad disminuye debido a la apoptosis inducida por señales desconocidas.
El colágeno, principal proteína estructural del tejido cicatricial, proporciona la fuerza tensora a la cicatriz. En la cicatrización normal hay un equilibrio entre la producción de colágeno y su degradación. Las colagenasas producidas por leucocitos y macrófagos se encargan de la destrucción del colágeno. La síntesis de colágeno se produce en exceso en fases iniciales y, aunque luego se degrada, siempre permanece en cantidades superiores a la de la piel normal.
A lo largo del proceso de cicatrización predominan diferentes tipos de colágeno. En fases iniciales se sintetiza y deposita colágeno tipo III, pero es rápidamente reemplazado por tipo I, el predominante en la piel.
Las células endoteliales promueven la angiogénesis necesaria para abastecer de oxígeno y nutrientes la zona de cicatrización. Una vez establecido el flujo vascular unos capilares desaparecen tras la remodelación y otros se diferencian en arterias y venas.
Remodelación
La remodelación es la fase más larga de la cicatrización. El depósito de colágeno en los tejidos es un balance entre la actividad colagenolítica y la síntesis de colágeno. Durante la remodelación, la fuerza tensional aumenta a pesar de la disminución de la cantidad de colágeno. Este fenómeno es debido a la modificación estructural del colágeno depositado.
Los fibroblastos, encargados de la formación de matriz extracelular, son responsables también de su degradación mediante la síntesis de colagenasas. Los fibroblastos también secretan sustancias que inactivan las colagenasas para controlar su acción.
La remodelación es un proceso dinámico de maduración de la cicatriz que puede durar meses o años. Este es, sin embargo, un proceso imperfecto y el colágeno de la cicatriz no alcanza el patrón de organización normal, por lo que la fuerza tensional de la cicatriz nunca es igual a la de la piel indemne. La herida tiene sólo el 5% de su resistencia a la tracción original a las 2 semanas y el 35% un mes después, siendo alcanzada la resistencia definitiva pasados varios meses de la injuria.
Contracción
La última fase ( contracción ) es el proceso por el cual el área de superficie cruenta disminuye mediante la reducción concéntrica del tamaño de la herida. La contracción no se produce en presencia de tejido necrótico o infección local.
Los miofibroblastos, que son el principal tipo de células del tejido de granulación, son fibroblastos modificados que presentan algunas características típicas de las células musculares lisas. Contienen haces de microfilamentos con cuerpos densos, similares a aquellos encontrados en las células musculares lisas y pueden expresar, dependiendo de las situaciones, proteínas del citoesqueleto específicas cómo ?-actina, desmina, y cadenas pesadas de miosina de las células musculares lisas. Estas características sugieren que los miofibroblastos son responsables por la fuerza de contracción de la herida y por las contracturas patológicas observadas en las cicatrices hipertróficas.
Resumiendo:
|
Hemostasia |
Inflamación |
|
?Vasoconstricción |
? Vasodilatación Calor, rubor, tumor y dolor |
|
Proliferación |
Remodelación |
Contracción |
|
?Síntesis de factores de crecimiento por fibroblastos, queratinocitos y células endoteliales |
?Las colagenasas degradan parte del colágeno sintetizado |
? Reducción concéntri- ca del tamaño de la herida ( por la acción de los miofibroblastos ) |
COMPOSICIÓN DE LAS CICATRICES
Durante la descripción de los mecanismos involucrados en la cicatrización de las heridas, hemos visto la importancia inherente al colágeno y su participación en las propiedades de la cicatriz.
Sin embargo, no podemos dejar de nombrar otros componentes que también juegan un papel más o menos primordial en la constitución de la cicatriz final y que serán objeto de análisis en el estudio experimental que veremos más adelante.
Uno de ellos son las fibras elásticas, responsables de la mayor o menor elasticidad del tejido.
Esta fibras están compuestas esencialmente de elastina ( glocuproteína ) rodeada de microfibrillas ( formadas por fibrilina ) . Las moléculas de elastina se disponen formando una red, plegada al azar en espiral, lo que determina su capacidad de extenderse y volver a la posición inicial. En un estudio reciente, se ha mostrado que la elastina y fibrilina están presentes 7 días después de la lesión. Sin embargo, pocos datos se saben de la organización detallada del sistema de fibras elásticas en las cicatrices.
Entre los otros componentes de la matriz extracelular de la dermis, la tenascina parece jugar un papel importante en el proceso de la cicatrización. Se trata de una glucoproteína escasamente distribuida en la piel normal, predominantemente asociada a las láminas basales. En las fases tempranas de la cicatrización y durante la formación del tejido de granulación, hay un marcado aumento en la expresión de la tenascina, pero ésta vuelve a los niveles normales después del final de la contracción de la herida.
La laminina es otra glucoproteína dérmica, esencial para los fenómenos de adhesión celular a la membrana basal, estructura laminar que separa la región epidérmica de la dérmica cuyas funciones más importantes son formar una barrera mecánica, un soporte de los tejidos que delimita, filtro para diferentes solutos y un lugar de adhesión de moléculas.
FACTORES QUE INTERVIENEN EN LA CICATRIZACIÓN
La cicatrización de las heridas se modifica por factores locales y generales.
Los factores locales son:
- Tamaño y tipo de la herida;
- Infección ( su presencia retarda la cicatrización );
- Localización y vascularización ( curan antes las heridas en áreas bien vascularizadas y con menor tensión cutánea );
- Radiaciones ( las radiaciones ultravioleta aceleran la curación de las heridas, sin embargo las ionizantes la retardan );
Los factores sistémicos que entorpecen la cicatrización son:
- Infecciones sistémicas;
- Vasculopatías;
- Medicamentos cómo los antiinflamatorios no esteroideos, los corticoides, la penicilamina, los anticoagulantes o antineoplásicos;
- Edad avanzada;
- Alcoholismo y tabaquismo;
- Malnutrición;
- Patologías asociadas cómo una uremia aguda, diabetes, anemia grave, etc.
Hay otros factores de tipo externo que también interfieren en la calidad de la cicatrización, cómo puede ser la técnica de sutura empleada.
CICATRIZACIÓN PATOLÓGICA
La patogenia de las cicatrices anómalas no se conoce por completo, pero es un hecho demostrado que las cicatrices hipertróficas y los queloides se apartan pronto del proceso normal de reparación de las heridas.
En el proceso normal de cicatrización, después de la reepitalización, la disminución del numero de células durante la transición entre el tejido de granulación y la cicatriz es mediada por apoptois, ocurriendo una impresionante remodelación de la matriz extracelular. Durante la cicatrización excesiva, los mecanismos se alteran. El tejido de granulación no regride y las células, especialmente los miofibroblastos, están continuamente activos y producen matriz extracelular. Así, aumenta la producción de colágeno, disminuye su degradación y se altera la composición de los proteoglicanos, resultando en un tejido más rígido, con un colágeno viejo y poco organizado.
Aunque algunas cicatrices hipertróficas pueden, espontáneamente regredir, otras permanecen activas durante años. Se puede afirmar que la verdadera diferencia entre el queloide y la cicatriz hipertrófica es la falla en la fase de remodelación que existe en el queloide. Cuánto a la organización del colágeno, en las cicatrices hipertróficas las fibras están orientadas un tanto paralelas al eje longitudinal de la herida mientras que en los queloides se orientan completamente de manera casual, con la presencia de bultos de colágeno.
El TGF-ß se ha involucrado en la patogenia de la cicatrización excesiva a través del aumento del depósito de colágeno.
Aunque la angiogénesis suele regresar durante la fase de remodelación del proceso de cicatrización normal, los queloides y las cicatrices hipertróficas se caracterizan por la persistencia de la hiperemia, debida a la presencia constante de nuevos vasos en la zona. Otros factores implicados en el desarrollo de las cicatrices anómalas son el ácido hilalurónico y los mastocitos, entre otros.
TRATAMIENTO
Cómo se ha dicho anteriormente, lo mejor es la terapia combinada para redimir una secuela que será persistente.
Las opciones terapéuticas disponibles en la actualidad son, entre otras:
? Excisión quirúrgica ( en los queloides se debe tener en cuenta el elevado riesgo de recidiva ).
? Corticoides intralesionales
? Presoterapia
? Placas de silicona - también se pueden utilizar en forma de gel o cremas con
similares resultados. La silicona funciona como una membrana impermeable que mantiene la herida hidratada, simulando un estrato córneo.
? Láser - los resultados obtenidos con diferentes tipo de láser ( de argón, dióxido de carbono o YAG ) han sido inconstantes. Se cree que la mayor ventaja de la escisión con láser es que traumatiza menos los tejidos y disminuye así la reacción inflamatoria y la consecuente fibrosis. Lo que se está utilizando es la combinación del láser con otras modalidades que incluyen interferón, triamcinolona y placas de silicona. Debido al coste del equipo y sus resultados, que son muy similares a otros métodos, hacen que no sea una buena opción.
? Radioterapia - la radiación logra actuar sobre las estructuras de colágeno y aumenta la apoptosis de los fibroblastos, trayendo como consecuencia una normalización de la población celular. Se utiliza en conjunción con la cirugía para lesiones más antiguas.
? Crioterapia - consiste en un enfriamiento y calentamiento secuencial que trae como consecuencia muerte celular y reorganización tisular, en especial en la disposición de las fibras de colágeno. Tiene una eficacia reportada del 50-85% asociando aplanamiento de la herida y mejoría de los síntomas.
? Ultrasonidos y masaje
ESTUDIO CIENTIFICO
En el estudio que seguidamente se va a mostrar, se ha investigado, por histoquímica e inmunohistoquímica, la expresión y organización de los componentes de la matriz extracelular, incluyendo fibrilina, elastina y tenascina y la distribución de miofibroblastos en cicatrices hipertróficas tratadas o no con presión. También se ha evaluado, por microscopia de transmisión electrónica, las modificaciones de la unión dérmica-epidérmica y la presencia o no de apoptosis durante la remodelación de la cicatriz por presión inducida.
MÉTODO EXPERIMENTAL
Nueve pacientes, con edades comprendidas entre 18 y 54 años, que presentaban cicatrices hipertróficas provenientes de quemaduras, fueron seleccionados para el estudio. La edad de las cicatrices al principio del tratamiento iba desde los 3 a los 11 meses. Las biopsias fueron tomadas de 2 a 7 meses después del inicio del tratamiento con presión. Cada paciente tenía dos perforaciones de 3 mm, una en la región tratada con presión y la otra en una región adyacente no tratada. Biopsias de piel normal se usaron como controles. Las muestras de tejido fueron debidamente fijadas y tratadas, utilizando técnicas histológicas adecuadas.
Las secciones obtenidas fueron etiquetadas tras añadir anticuerpos primarios obtenidos de animales ( cómo el anti-fibrilina-1, anti-elastina, anti-tenascina, anti-laminina, anti-colágeno tipo IV, anti-colágeno tipo VII y anti-?-actina ). Estos anticuerpos han sido previamente bien caracterizados, son muy específicos y han sido usados extensivamente en otras condiciones experimentales y clínicas.
El grosor de la epidermis se midió utilizando un sistema computarizado de análisis de imagen.
RESULTADOS
En las regiones no tratadas, el grosor de la epidermis estaba aumentado ( 130.5 ± 35.5 ?m) en comparación con las regiones tratadas (106.9 ± 26.8 ?m). Además, la epidermis en ambos sitios estaba más gruesa comparada con la piel normal ( 44.8 ± 17.5 ?m ).
En la dermis, las regiones no tratadas con presión mostraron la organización típica de una cicatriz hipertrófica, con muchas células y numerosos vasos alrededor de las estructuras nodulares, no siendo posible definir la dermis papilar y reticular. En las regiones tratadas con presión el numero de vasos estaba reducido, en comparación con las zonas no tratadas. Además, en éstas últimas, los vasos fueron localizados principalmente en la dermis superficial, mientras que en las regiones tratadas la mayoría de los vasos fueron hallados en la dermis profunda, cómo en la piel normal.
En la piel normal, las fibras de colágeno reticulares estaban organizadas aleatoriamente en la dermis sin formar manojos. En las regiones no tratadas, algunos manojos de fibras reticulares se situaron perpendiculares a la unción dérmica-epidérmica. Por lo contrario, en las regiones tratadas, las fibras reticulares eran más delgadas con una distribución más bien paralela a la superficie dérmica, pareciéndose así a la piel normal.
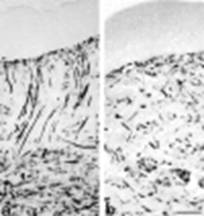
Fig. 1- Disposición de las fibras de colágeno en zonas dérmicas no tratadas (a ) y tratadas (b) con presión.
En la piel normal, las fibras elásticas se localizaron en la dermis reticular ( capa más profunda y gruesa de la dermis ), distribuidas, preferentemente, paralelas a la epidermis. En las regiones no tratadas, estas fibras estaban ausentes en la mayoría de los casos. Cuándo estaban presentes se localizaron en la dermis profunda, dónde eran cortas, delgadas y rizadas. En las regiones tratadas, las fibras elásticas se presentaron en toda la dermis, con una organización aleatoria diferente de la observada en la dermis normal, sin formar una red y con un aspecto fragmentado.
En un estudio más detallado del sistema elástico se obtuvieron los siguientes resultados:
En la piel normal, la fibrilina de la dermis papilar estaba presente en las fibras insertadas en la membrana basal, mostrando la llamada configuración en candelabro. Más profundamente, se observaron fibras más gruesas formando una red. En las regiones no tratadas, la organización de la fibrilina estaba desequilibrada: en la dermis superficial, el patrón en candelabro desapareció y la cantidad de fibrilina estaba reducida; en la dermis profunda, depósitos discretos de fibrilina, semejaban fibras fragmentadas. En las regiones tratadas, las fibras localizadas debajo de la unión dermoepidérmica estaban mejor organizadas en comparación con las regiones no tratadas y en la dermis profunda los depósitos de fibrilina eran casi normales, a pesar de que las fibras parecían más pequeñas.
La elastina, en la piel normal, estaba ausente bajo la epidermis, y en cambio se presentaba en grandes agregados de fibras horizontales en la dermis. En las regiones no tratadas, la elastina estaba presente en depósitos, sin formar fibras. En las regiones tratadas, alguna elastina se observó en la dermis superficial, cerca de la unión dérmica-epidérmica, siendo las fibras más pequeñas y delgadas que las normales.
En la piel normal, la tenascina se observó en la dermis papilar superficial y cerca de la lamina basal de las glándulas sudoríparas y vasos. En las regiones no tratadas, la tenascina se observó en toda la dermis, pero la coloración no era homogénea, sino más intensa en la epidermis, más débil en la región subyacente y nuevamente intensa. En las regiones tratadas, la tenascina se restringió a un fino depósito dentro de la dermis papilar y alrededor de los vasos, similar a la observada en la piel normal.
La distribución de laminina y colágenos tipo IV y VII presentes en la unión dérmica-epidérmica no mostró diferencias cuándo la piel normal y las regiones tratadas y no tratadas fueron comparadas.
En la piel normal, la ?-actina se observó exclusivamente en los vasos. En las regiones no tratadas, la proporción de miofibroblastos que expresaban ?-actina fue impresionante y localizada sobretodo en nódulos. En contraste, las regiones tratadas mostraron una significante disminución de miofibroblastos con ?-actina. Además, se observaron numerosas células fibroblásticas con características apoptóticas.
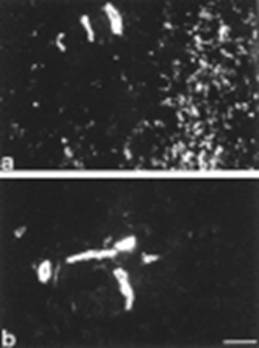
Fig. 2- Inmunofluorescencia de la ?-actina en piel no tratada (a) y tratada con presión (b).
A través del microscopio electrónico, se pudieron observar cambios morfológicos significativos en la unión dermoepidérmica. En la piel normal, se observó la organización típica de la lamina basal ( lámina lúcida y lámina densa ), con los desmosomas, filamentos de anclaje y fibrillas distribuidos regularmente. En las regiones no tratadas, la lámina densa estaba más gruesa y la lamina lucida no estaba claramente definida. Los hemidesmosomas y las fibrillas de anclaje no se presentaban regularmente distribuidos. Además, las fibrillas de anclaje eran más densas comparándolas con las observadas en la piel normal o en las zonas tratadas. Se observaron con frecuencia fibras de colágeno inmediatamente por debajo de la lámina densa. En las regiones tratadas, la unión dermoepidérmica se asemejaba a la de una piel normal, con hemidesmosomas bien organizados.
En las regiones no tratadas, se observaron manojos de gruesas fibras de colágeno mientras que en las regiones tratadas el colágeno apareció suelto y se observaron numerosos signos de remodelación de la matriz extracelular. Además, había una larga gama de diámetros de fibrillas de colágeno, con algunas fibrillas largas y enrolladas, cómo suelen verse durante la destrucción del colágeno.
Los microvasos estaban frecuentemente ocluidos sin algunas diferencias obvias entre las zonas tratadas y las no tratadas.
DISCUSIÓN DE LOS RESULTADOS
Poco se sabe sobre los mecanismos que llevan a la resolución de la cicatriz hipertrófica en los pacientes tratados con presión. El presente estudio relata los cambios estructurales en la dermis de cicatrices hipertróficas de quemaduras y, aunque sólo de manera descriptiva, aporta pruebas directas de la relación estrecha in vivo entre las modificaciones mecánicas, el fenotipo de la célula y la remodelación de la matriz.
La presión indujo una modificación en la organización del colágeno. La orientación desorganizada fue reemplazada, bajo presión, por una disposición paralela similar a la observada en la cicatrización normal, desapareciendo el patrón nodular. Además, se observó que en las cicatrices hipertróficas, las fibras de colágeno perpendiculares a la epidermis estaban ancladas en la unión dermoepidérmica.
Las fibras elásticas no son frecuentemente consideradas en los estudios de la cicatrización de heridas. Los primeros estudios que usaron técnicas histoquímicas, describieron la presencia de fibras elásticas sólo en fases tardías del proceso de la cicatrización pero investigaciones más recientes, usando el microscopio de transmisión electrónica y la inmunohistoquímica, han demostrado la presencia de algunos componentes del sistema elástico, fibrilina y elastina, también en las fases tempranas de la cicatrización en piel e hígado. En el presente estudio, se ha demostrado la presencia de ambos componentes en cicatrices hipertróficas, sin grandes alteraciones en la cantidad ( cuándo las comparamos con la piel normal ) pero con importantes desórdenes en su organización ( que pueden estar asociados con un sistema elástico aún inmaduro ). El tratamiento con presión permitió una reorganización de la fibrilina y elastina, con la adquisición de un patrón casi normal que les permite llevar a cabo sus funciones fisiológicas, cómo en la dermis normal. Esto puede explicar la suavidad adquirida por las cicatrices cómo consecuencia del tratamiento de presión.
Durante la cicatrización normal, la tenascina es abundante en el tejido de granulación, pero desaparece pronto, después de la reepitalización. Los descubrimientos de los autores del presente estudio, que muestran una impresionante acumulación de tenascina en las regiones no tratadas, sostienen la hipótesis de que las cicatrices hipertróficas se desarrollan cómo consecuencia de un proceso de cicatrización excesivo. En las regiones tratadas, así cómo en la piel normal, la tenascina estaba presente en las papilas dérmicas y en la lamina basal de los vasos. Poco se sabe sobre el papel de la tenascina en la cicatrización de heridas. Sin embargo, al revisar la literatura, se ha postulado que la presencia de tenascina permite a los fibroblastos contraer la herida. En el caso de las cicatrices hipertróficas, la continua presencia de tenascina puede contribuir al desarrollo de contracturas.
Se pudo observar también que las cicatrices hipertróficas presentaban una unión dermoepidérmica desorganizada, y que después del tratamiento hubo una marcada mejora en su organización. Entre los cambios observados como consecuencia de la presión, los hemidesmosomas presentaron una ultraestructura normal y una distribución regular. Además, las diferencias observadas, a través del M.O.E., en la organización de la unión dermoepidérmica entre la piel normal, piel no tratada y piel tratada, sugieren sutiles modificaciones en la organización de los filamentos de anclaje.
CONCLUSIONES
La reorganización de la matriz extracelular, que también envuelve la degradación del colágeno, junto con la desaparición de miofibroblastos, puede explicar las mejorías obtenidas con presión en las propiedades mecánicas de la cicatriz. Los autores sugieren que la presión induce la disminución del numero de células similar a aquella observada en las fases finales del proceso de cicatrización normal, dónde la apoptosis es el mecanismo a través del cuál las células vasculares y los fibroblastos son eliminados gradualmente.
Varias son las teorías respecto al mecanismo de acción de la presión. Kischer et al sugirieron que la hipoxia, que causa una cicatrización hipertrófica, está aumentada por la presión y causa la resolución de la cicatriz por inducción de la muerte del fibroblasto. Baur et al discreparon y sugirieron que el tratamiento causaba un aumento en la actividad de la colagenasa y un consecuente aumento en la degradación de la matriz extracelular.
En conclusión, los autores sugieren que el tratamiento de las cicatrices hipertróficas por presión induce una reorganización en la matriz extracelular y apoptosis en células fibrogénicas ( miofibroblastos ) y vasculares.
En este ámbito de estudio, podemos mirar hacia otro tipo de fuerzas mecánicas y preguntarnos si realmente producen efectos similares, cómo pueden ser los ultrasonidos y la aplicación de masaje en las cicatrices.
Aunque pocos estudios hay sobre los efectos fisiológicos del masaje, la evidencia clínica no niega los beneficios que esta terapia aporta a la cicatriz hipertrófica. Tras una ardua búsqueda en manuales de masoterapia y artículos científicos, uno de los pocos hallazgos importantes encontrados fue un estudio con pacientes coreanos quemados. Después del tratamiento con masaje, los pacientes mostraron una reducción en el prurito, una mejora en el estado de la piel, flexibilidad, vascularización y altura de la cicatriz, todo ello con las respectivas repercusiones en el estado de ánimo.
Estos resultados se podrían explicar objetivamente con pruebas y fundamentos bioquímicos e histológicos cómo los utilizados anteriormente en el caso de la presión mecánica? Podría haber una modificación similar en el metabolismo del colágeno y en la organización de las proteínas de la matriz?
Podríamos deducir que tras la aplicación de ambas terapias en cicatrices diferentes, algunas reacciones análogas en la composición de la matriz podrían ocurrir, explicando así la proximidad de los resultados obtenidos. De cualquier forma, estudios más objetivos son necesarios para clarificar preguntas de este tipo.
De igual manera, el “micromasaje” producido por las ondas ultrasónicas ( asociado o no al factor térmico ) puede ser otro instrumento útil para mejorar la calidad del tejido cicatricial. Se ha demostrado que los ultrasonidos favorecen el proceso de regeneración en varios tejidos y aumentan la extensibilidad en aquellos que contienen colágeno. Las mismas preguntas nos podríamos hacer en este caso, pero las respuestas serían, una vez más, poco fundamentadas o incompletas.
Lo que no podemos negar es que, el paso de cualquiera de las fuerzas mecánicas descritas por una cicatriz, no pasa inadvertida, e induce cambios que finalmente se traducen por una mejora tanto de la flexibilidad cómo de la altura de la cicatriz y del estado de la piel en general.
Estos resultados deben hacernos pensar que los beneficios obtenidos en la práctica clínica diaria de muchos fisioterapeutas tienen por base mecanismos bioquímicos que poco a poco se irán clarificando y haciendo de la fisioterapia una disciplina con una evidencia científica cada vez más amplia.
BIBLIOGRAFÍA
Roh YS, Cho H, Oh JO, Yoon CJ ,“Effects of skin rehabilitation massage therapy on pruritus, skin status, and depression in burn survivors “, Taehan Kanho Hakhoe Chi. 2007 Mar;37(2):221-6.
Monte Alto Costa, A.; Peyrol, S.; Cristóvão Pôrto, L.; Comparin, J.Pierre; Foyatier, J.Luis y Desmoulière, A., “Mechanical Forces Induce Scar Remodeling” Am J Pathol. 1999 November; 155(5): 1671–1679
